专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18
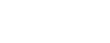

按照发生DDI的原理,可分为:
1
药效学DDI
相加作用1+1≈2
协同作用1+1>2
拮抗作用1+1<1
2
药动学DDI
吸收:胃肠道pH值的影响;胃排空及肠蠕动;络合螯合;吸附;肠内代谢;其他
分布:改变蛋白结合部位(置换);改变组织血流量
代谢(40%):酶的抑制;酶的诱导
排泄:肾小球的滤过(结合型药物不能通过肾小球的滤过膜);肾小管的重吸收(被动吸收);肾小管主动分泌的改变(转运体)
3
药剂学DDI
药物配伍相互作用(物理化学变化)
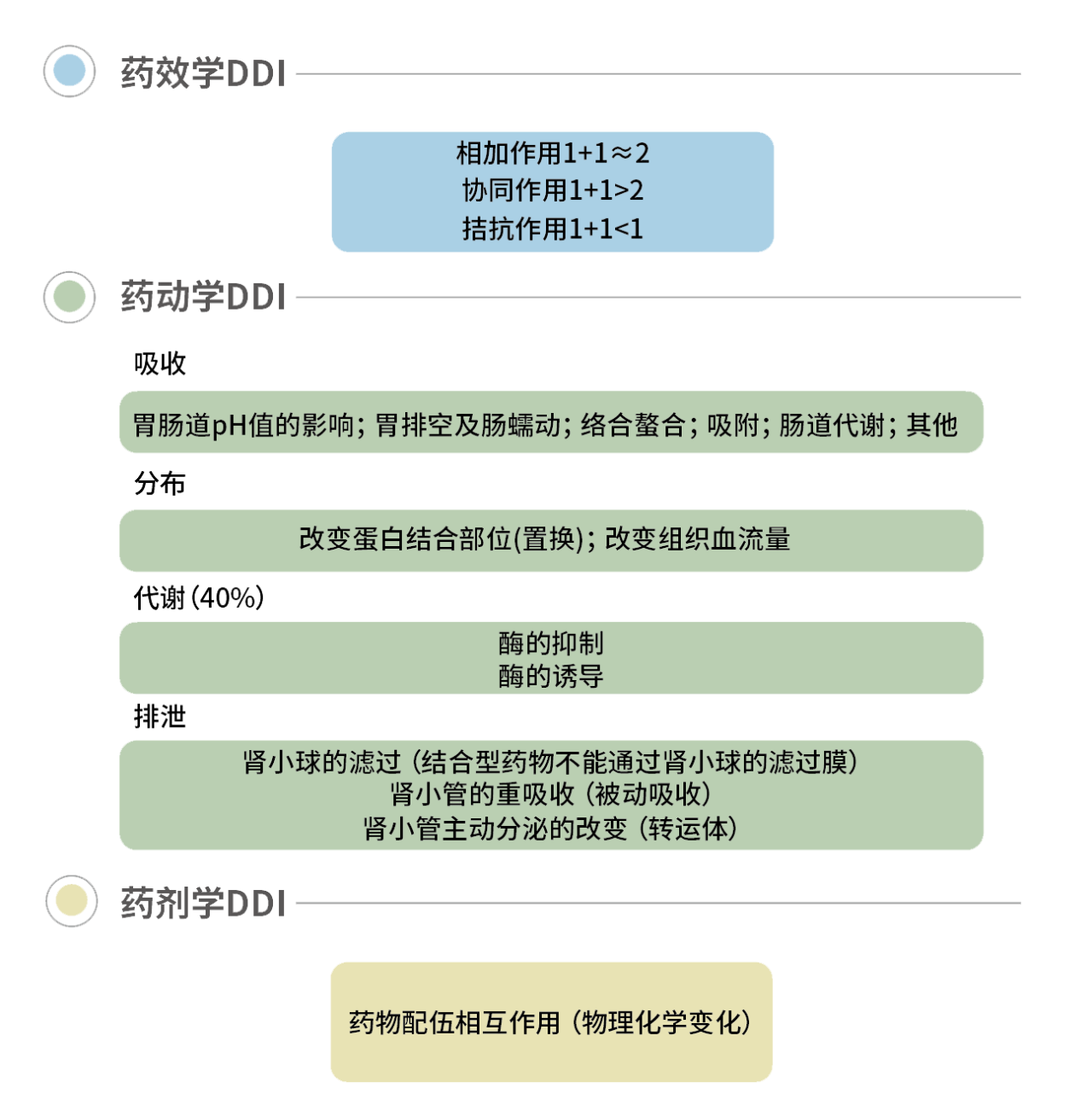
一、代谢酶介导的DDI研究策略
药物代谢的主要场所是肝脏。肝脏进行生物转化则依赖于微粒体中的多种酶系,其中最重要的是细胞色素P450混合功能氧化酶系统。代谢性相互作用的96%是由P450酶系介导。
正常人肝微粒体10种CYP450含量的构成比
▲ 图源 | 药学进展,人肝CYP450酶含量与活性研究进展
代谢酶介导的DDI研究策略图
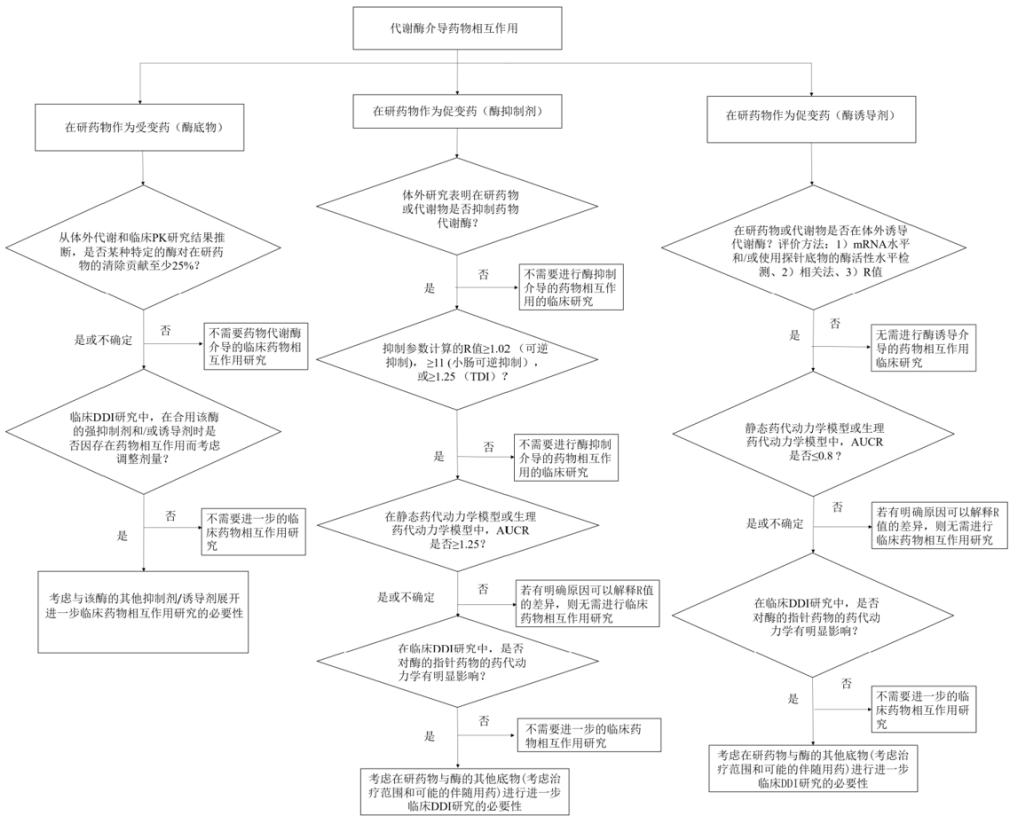
▲ 图源 | CDE《药物相互作用研究技术指导原则(试行)》
DDI的主要研究内容包括但不限于:
1
是否是促变药
在研药物是否可改变其它药物的药代动力学特征;
2
是否是受变药
其它药物是否可改变在研药物的药代动力学特征
3
DDI的程度
评估在研药物药代动力学参数的变化程度
4
DDI的临床意义
评估在研药物DDI的临床意义
5
DDI的预防措施
临床严重DDI的防控策略
二、临床DDI研究的设计与实施要点
ICHM12系统规范了临床DDI研究的类型、设计和实施要求,问答文件对样本量等关键参数提供了具体指导。
2.1 研究类型选择
1️⃣独立与嵌套DDI研究
独立研究以DDI评价为主要目的;嵌套研究作为其他临床试验(如II/III期)的一部分,需预先规划和适当设计。
2️⃣指针药物研究
使用强效指针抑制剂/诱导剂评估最大DDI潜力,结果可外推至相同机制的其他药物。
3️⃣预期合并用药研究
评价与目标人群可能合用药物的DDI,更具临床针对性但其结果可能难以外推至其他药物。
4️⃣鸡尾酒法
同时评价多种酶/转运体的抑制/诱导潜力。
5️⃣生物标志物法
使用内源性底物(如CPI、4β-羟基胆固醇)评估DDI潜力。
2.2 关键设计考虑
1️⃣样本量
通常每组12-20例,变异大或特定目的时需增加。应能可靠评估DDI程度和变异度。
2️⃣剂量选择
促变药:临床最大剂量+最短间隔(评价最大DDI可能);
受变药:线性范围内任选剂量,或最可能观察到DDI的治疗剂量。
3️⃣给药方案
抑制剂:多剂量给药(除非仅吸收环节作用);
诱导剂:7-14天预处理以达到最大诱导;
底物:若无非时间依赖性PK,可单次给药,若其具有时间依赖性药代动力学特征,则底物药物和促变药均应以多次给药的方式进行DDI评价。
4️⃣研究人群
健康受试者(可外推时)或目标患者人群(安全性考虑时)。
5️⃣试验设计
优先选择交叉设计(减少变异);
若半衰期长,可采用平行设计(需更大样本量)。
6️⃣采样与数据分析
采样需覆盖完整AUC(包括半衰期延长情况);
检测原形药+关键代谢产物(若机制复杂);
可稀疏采样促变药以确认暴露水平。
2.3 特定酶/转运体DDI评价注意事项
1️⃣CYP酶底物
首选强指针抑制剂/诱导剂;
若结果阴性,无需进一步研究相同酶的其他促变药;
若阳性,进一步评估中效促变药或使用模型预测。
2️⃣CYP酶抑制剂或诱导剂
底物选择:首选对目标CYP酶活性变化最敏感、特异性高的指针底物进行初始研究。需综合考虑底物的特异性和在研药物的抑制/诱导特征。
研究决策:
阴性结果:若与最敏感底物无相互作用,则无需研究该通路敏感性更低的其他底物。
阳性结果:若发现存在相互作用,则应进一步研究相关的合并用药底物,并评估其临床意义。
复杂情况:若在研药物同时具有抑制和诱导作用,其净效应可能随时间变化(初期抑制为主,后期诱导为主)。研究设计需包含早期和晚期的药代动力学采样点,以捕捉这种动态变化。
3️⃣作为UGT底物的药物
DDI幅度:UGT抑制导致的DDI通常比CYP酶介导的DDI程度更小。
研究决策:是否进行临床DDI研究取决于药物的安全窗和与UGT抑制剂合并使用的可能性。
其他考量:
需注意UGT抑制剂可能影响其他途径,导致复杂机制。
建议同时监测原形药及其葡萄糖醛酸代谢物,以阐明机制并评估活性/毒性代谢物的风险。
可利用UGT基因多态性数据来评估代谢途径的重要性和潜在DDI程度。
需注意CYP3A诱导剂(通过PXR/CAR)也可能诱导UGT,从而影响UGT底物。
4️⃣作为UGT抑制剂的药物
UGT抑制的临床意义通常有限,一般不强制要求进行临床DDI研究。
决策时需综合考虑体外抑制数据和与特定UGT底物合并使用的可能性及该底物的安全性。
5️⃣作为UGT诱导剂的药物
UGT可被PXR/CAR激动剂(如CYP3A诱导剂)诱导,但诱导程度弱于CYP3A。
研究策略:如果一个药物在临床研究中被证实是中效或强效CYP3A诱导剂(使敏感底物AUC降低≥50%),则应考虑其诱导UGT的潜力,并基于与UGT底物合用的可能性和安全窗等因素,决定是否进行专门的UGT DDI研究。
特别注意:某些药物可能同时抑制CYP3A但诱导UGT,需综合判断其净效应。
2.4 结果解读标准
无效应界值
最佳基于暴露-效应关系,默认80-125%一般可接受。
三、案例分享——Dasatinib(Sprycel®)
Dasatinib(达沙替尼)是一种由百时美施贵宝(BMS)开发的酪氨酸激酶抑制剂,用于治疗慢性期、加速期或急变期的慢性髓细胞白血病(CML),以及对既往治疗耐药或不耐受的费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)。
药物名称:Dasatinib(Sprycel®)
化学名称:N-(2-氯-6-甲基苯基)-2({6-[4-(2-羟基乙基)哌嗪基-1]-2-甲基嘧啶基-4}氨基)-1.3-噻唑-5-酰胺,一水合物
主要成分:达沙替尼
化学结构式:
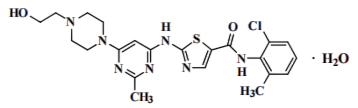
分子式:C22H26ClN7O2S•H2O
分子量:506.02(一水合物)
体外研究表明,达沙替尼是一种时间依赖性的CYP3A4抑制剂,因此可能影响CYP3A4底物的药代动力学。
体内研究如下:
试验设计:
为了研究达沙替尼的抑制潜力,进行了与辛伐他汀(一种CYP3A4底物)的药物相互作用研究。48名健康成年受试者在空腹条件下接受以下两种治疗,每种治疗之间均有7天的洗脱期:
•队列A:辛伐他汀 80mg(单次剂量)
•队列B:辛伐他汀 80mg与达沙替尼100mg
由于达沙替尼是一种时间依赖性的CYP3A4抑制剂,因此达沙替尼的剂量应达到稳态水平因此,本研究的结果可能低估了达沙替尼对CYP3A4的抑制潜力。
结果如下:

▲ 图源 | Dasatinib ablets ,Clinical pharmacology and biopharmaceutics riview(s), FDA.
几何均值比(Cmax)和AUC的90%可信区间表明,达沙替尼的联合使用会增加辛伐他汀的暴露量。当与单次剂量的100毫克达沙替尼联合使用时,辛伐他汀的暴露量增加了20%至23%,Cmax增加约37%。这表明达沙替尼具有CYP3A4抑制潜力,但其抑制作用不足以被视为弱抑制剂。由于该研究的设计并非最优化,达沙替尼的抑制潜力可能比本试验结论更为显著。
说明书中体现为:
达沙替尼与CYP3A4底物同时使用可能会增加CYP3A4底物的暴露。因此,当达沙替尼与具有较窄治疗指数的CYP3A4底物联用时应当谨慎,这些底物包括阿司咪唑、特非那定、西沙必利、匹莫齐特、奎尼丁、苄普地尔或麦角生物碱类(麦角胺、双氢麦角胺)。
更多详情 · 请联系
电话:021-3178-5055
邮箱:yiyao-marketing@weipugroup.com