专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18
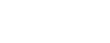

 近年来,国际权威药品监管机构如FDA、EMA和国家药监局等都明显加强了对亚硝胺杂质的监管力度。针对该类杂质(小分子亚硝胺及NDSRIs)的推荐可接受摄入量的制定,FDA已更新至2025年07月29日版本,EMA已更新至2025年08月01日版本。
近年来,国际权威药品监管机构如FDA、EMA和国家药监局等都明显加强了对亚硝胺杂质的监管力度。针对该类杂质(小分子亚硝胺及NDSRIs)的推荐可接受摄入量的制定,FDA已更新至2025年07月29日版本,EMA已更新至2025年08月01日版本。
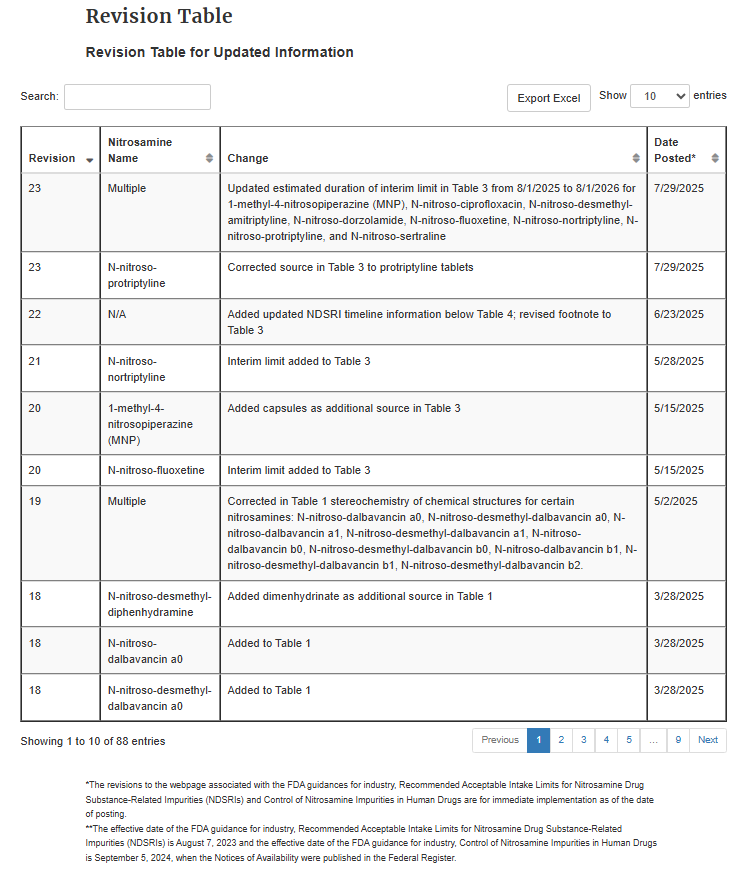
▲ 图源丨CDER Nitrosamine Impurity Acceptable Intake Limits
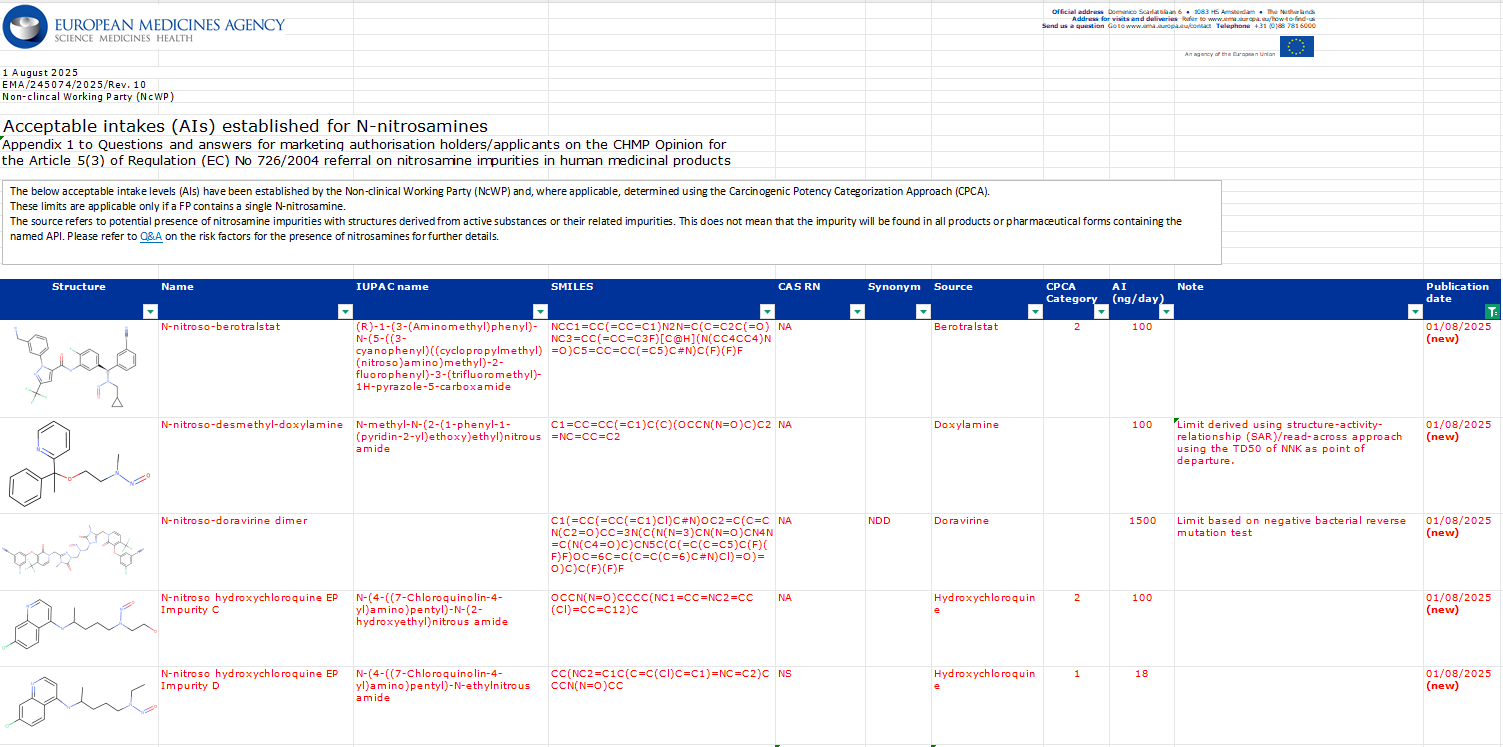
▲ 图源丨EMA Nitrosamine impurities: guidance for marketing authorisation holders
近期国内审评针对亚硝胺的发补案例如下:
示例1

▲ 图源丨CDE
示例2

▲ 图源丨CDE
 亚硝胺杂质是一类重要的遗传毒性化学致癌物。亚硝胺在人体内通过细胞色素P450催化,其α-碳原子被羟基化,随后降解产生重氮离子或烷基正离子。这些活性中间体能够通过破坏染色体结构、影响细胞分裂和DNA表达等方式,为癌症的发生埋下隐患1。
亚硝胺杂质是一类重要的遗传毒性化学致癌物。亚硝胺在人体内通过细胞色素P450催化,其α-碳原子被羟基化,随后降解产生重氮离子或烷基正离子。这些活性中间体能够通过破坏染色体结构、影响细胞分裂和DNA表达等方式,为癌症的发生埋下隐患1。
亚硝胺杂质的毒性机理
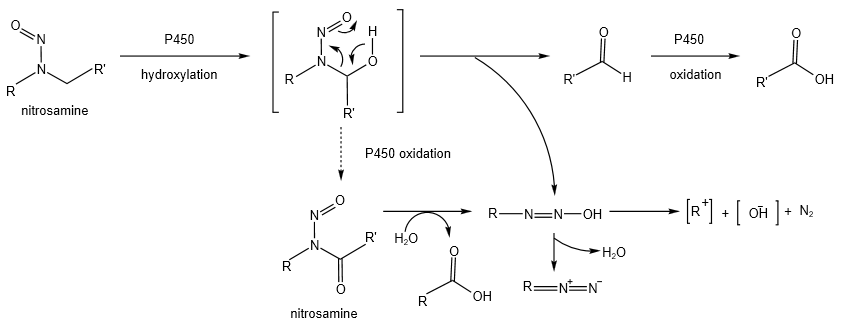
▲ 图源丨A Review on Mechanism of Nitrosamine Formation, Metabolism and Toxicity in In Vivo.

亚硝胺杂质产生的一般条件包括:
1
亚硝胺杂质可以通过胺(仲胺、叔胺或季胺)与亚硝化试剂(酸性条件下的亚硝酸盐)在特定条件下通过亚硝化反应形成。
如下图所示:
亚硝胺杂质的形成机理
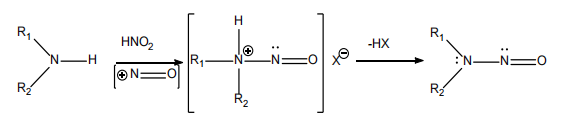
▲ 图源丨FDA 《Recommended Acceptable Intake Limits for Nitrosamine Drug Substance Related Impurities (NDSRIs) Guidance for Industry》文件
▲ 图源丨PMDA《Approaches and considerations for N-nitrosamine issues from a quality perspective》文件
2
NDSRIs(与药物结构相关的亚硝胺类杂质)为具有仲胺、叔胺或季胺的原料药(或原料药片段)通过亚硝化反应形成。
如下图所示:
NDSRIs杂质的形成机理
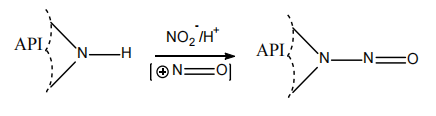
▲ 图源丨FDA 《Recommended Acceptable Intake Limits for Nitrosamine Drug Substance Related Impurities (NDSRIs) Guidance for Industry》文件
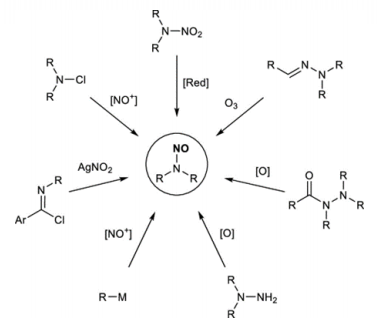
亚硝胺杂质可能的来源包括但不限于:
1
胺类官能团
2
亚硝酸盐
3
供应商提供的含有亚硝胺杂质的原辅料
4
回收的溶剂、试剂和催化剂
5
空气暴露、pH条件等
6
使用硝化纤维类包材
部分泡罩包装材料含有亚硝酸纤维素,当与含胺类印刷油墨接触时,在热封过程中可能发生化学反应生成亚硝胺。此外,包装印刷油墨若含有仲胺、叔胺等物质,在印刷或接触药物过程中,也可能通过化学反应与亚硝酸盐生成亚硝胺杂质。
 杂质限度=每日可接受摄入量/每日最大暴露量
杂质限度=每日可接受摄入量/每日最大暴露量
每日可接受摄入量(daily acceptable intake, AI)可参照FDA或EMA发布的亚硝胺杂质推荐可接受限度清单设定的亚硝胺类物质AI值。对于官方文件中没有推荐AI值的NDSRIs,可以应用预测致癌性潜力分类方法(CAPA),根据结构-生物活性关系(SAR)并结合NDSRIs的激活和失活结构特征,预测NDSRIs的致癌性分类和推荐的AI限度。
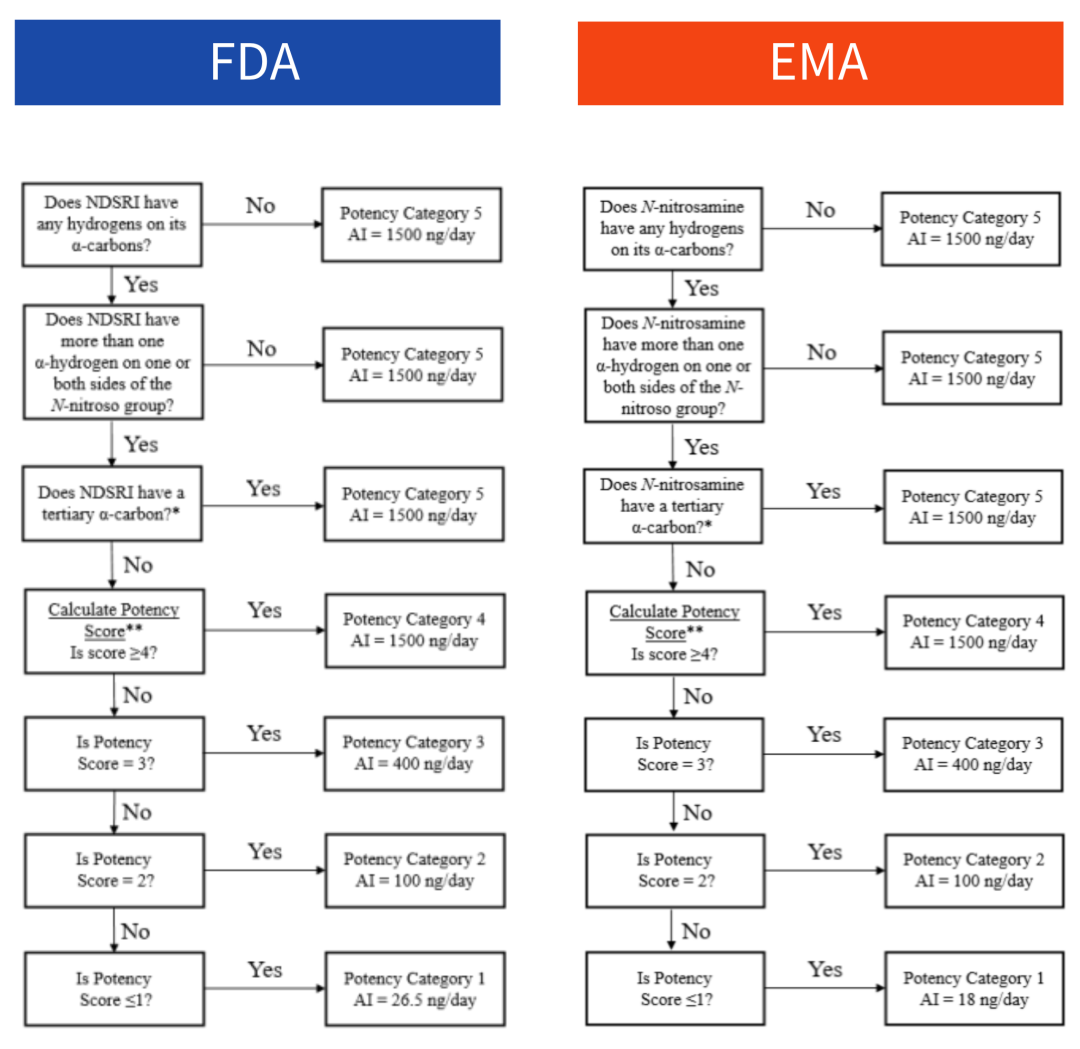
▲ 图源丨预测NDSRIs的致癌性潜力类别和确定推荐AI限度流程图
(左:FDA ,右:EMA)

当确认药品中存在亚硝胺杂质时,了解这些杂质的风险因素和根本原因至关重要。这一认识为实施有效的风险缓解和控制策略提供了基础,以确保亚硝胺水平保持在可接受限度范围内。
根据验证性测试的分析结果,可能出现情况及控制策略如下:

 微谱医药实验室面积超40000㎡,均参照GMP和ISO/IEC17025质量体系运行。由800余人组成的国际化专业团队,配合400多台大型精密仪器,持续为客户提供智慧精准、敏捷的专业研究服务。我们与国内外知名仪器方——安捷伦、赛默飞、SCIEX、布鲁克、三泉中石等分别成立联合实验室,持续探索实验室运行的创新模式,为客户提供专业的亚硝胺杂质研究服务!
微谱医药实验室面积超40000㎡,均参照GMP和ISO/IEC17025质量体系运行。由800余人组成的国际化专业团队,配合400多台大型精密仪器,持续为客户提供智慧精准、敏捷的专业研究服务。我们与国内外知名仪器方——安捷伦、赛默飞、SCIEX、布鲁克、三泉中石等分别成立联合实验室,持续探索实验室运行的创新模式,为客户提供专业的亚硝胺杂质研究服务!
扫码领取FDA/EMA最新汇总
NDSRIs杂质及推荐限度清单

*FDA已更新至2025年07月29日版本
EMA已更新至2025年08月01日版本
参考资料:
1. https://impactfactor.org/PDF/IJTPR/6/IJTPR,Vol6,Issue4,Article7.pdf
2.EMA 2021. Angiotensin-II-receptor antagonists (sartans) containing a tetrazole group – referral.
3.FDA 2024. Control of Nitrosamine Impurities in Human Drugs Guidance for Industry.
4.FDA 2023. Recommended Acceptable Intake Limits for Nitrosamine Drug Substance Related Impurities (NDSRIs) Guidance for Industry.
5.EMA 2025. Nitrosamine impurities: guidance for marketing authorisation holders.
6.PMDA 2024. Approaches and considerations for N-nitrosamine issues from a quality perspective.
7.APIC 2025. Nitrosamine Risk Management: Guidance for API Manufacturers.
8.Sharma Veena 2014. A Review on Mechanism of Nitrosamine Formation, Metabolism and Toxicity in In Vivo.
关于我们
微谱在生物医药领域致力于成为您值得信赖的医药研发伙伴。我们密切关注全球生物医药行业发展趋势,立足药物及医疗器械实验室服务全产业价值链,以完备的质量体系、高速的交付周期、丰富的项目经验及持续扩张的能力布局,为行业提供契合全生命周期的化学药、生物制品、医疗器械的研发及相关实验室服务,法规咨询与合规验证,药学CMC,临床医学研究等。我们的服务得到了中国、欧盟、美国、WHO等国际主要市场监管机构的认可,成功助力4500余家医药、医疗器械企业加速产品上市进程!
更多详情 · 请联系
电话:021-3178-5055
邮箱:yiyao-marketing@weipugroup.com