专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18



赵清佳
——
微谱化药事业部毒理学研究专家
赵清佳,微谱化药事业部毒理学研究专家,中国医药工业研究总院药物分析专业硕士,深耕毒物分析技术开发与代谢机制研究领域。她拥有6年毒理学领域专业知识沉淀,含4年国内外药品及化学品毒理学风险评估实战经验,专注于为产品提供从研发到上市的全流程安全性合规解决方案。赵老师精通 ICH S 系列(药品)、OECD 测试指南、ECETOC TRA 及 REACH 等多国法规体系,能精准适配 NMPA、FDA、EMA等不同监管市场的合规要求,拥有丰富的产品申报/核查经验。
▲ 微谱化药事业部毒理学研究专家赵清佳老师演讲
赵老师的演讲围绕以下主题展开:一毒理学风险评估的定义,二毒理学风险评估的四部曲,三毒理学风险评估的应用案例。
一
毒理学风险评估的定义
毒理学风险评估(Toxicological Risk Assessment,TRA)是确保药物安全性的关键环节。具体来说,它是指评估产品中每种成分的毒理特性和成品中这些成分混合后的毒理特性,结合产品在实际使用过程中暴露的情况,评估可能产生的健康风险,以辅助判断产品是否符合各个国家或地区的相关法律和法规要求。
▲ 毒理学风险评估是确保药物安全性的关键环节
从应用场景来看,毒理学风险评估可以应用于元素杂质、有机杂质、API活性成分等的研究。展开来讲:
01 应用场景-元素杂质:
<
来源:
①可能为有意添加的催化剂的残留;
②也可能为实际存在(生产设备、生产用水、辅料、包装容器引入);
应用:
①评估潜在元素杂质的毒性数据;
②确定每一种有毒元素的PDE;
③运用基于风险的方法控制药品中的元素杂质。
参考指导原则:
ICH Q3D(R2)元素杂质指导原则
02 应用场景-有机杂质:
<
来源:
①残留溶剂、副产物、降解杂质、非活性成分引入的杂质等;
②在生产过程中与生产设备或包装系统相互作用产生;
应用:
①评估有机物的毒性数据;
②确定每种有机物的PDE/AI;
③运用基于风险的方法控制药品中的有机杂质:将一般杂质控制在可接受的范围内,将基毒杂质控制在致癌风险可忽略的程度。
参考指导原则:
ICH Q3C(R9)杂质:残留溶剂的指导原则
ICH Q3E 可提取物与浸出物指南
ICH M7 评估和控制药物中DNA反应性(致突变)杂质以限制潜在致癌风险
03 应用场景-API活性成分:
<
来源:
①药品生命周期内在生产设备中残留的物质(残留的活性成分(降解产物)、清洁剂及微生物等);
应用:
①分析残留物特性、评估残留物的毒性数据;
②确定残留物的基于健康暴露限度(HBEL);
③清洁工艺验证及持续清洁工艺确认中加以辅助。
参考指导原则:
CDE《清洁验证技术指南》
EMA《guideline setting health based exposure limits use risk identification manufacture different medicinal products shared facilities》
二
毒理学风险评估的四部曲
毒理学风险评估通常包括危害识别、危害表征、暴露评定和风险表征四个步骤。
1
危害识别:定性阶段
为了确定人体暴露化学物的潜在有害作用,这种有害作用产生的可能性以及产生这种有害作用的确定性和不确定性,需基于已知的资料和作用模式来评价对人体有害作用的证据充分性。
这一阶段涉及的毒理学试验包括急性毒性和局部毒性试验、亚慢性和慢性毒性试验、遗传毒性试验和致癌性试验、生殖发育毒性试验等。最终需要确定待评估化学物的毒作用的性质,如靶器官毒物、致突变物、致癌物、致畸物等。
危害识别的过程中,需要对来源于适当的数据库、经同行专家评审的文献及诸如企业未发表的研究报告的科学资料进行充分的评议。由于经常会出现资料不足的情况,因此进行危害识别的最好方法是证据权重法,其权重顺序一般是流行病学研究>动物毒理学研究>体外试验>定量结构-反应关系。
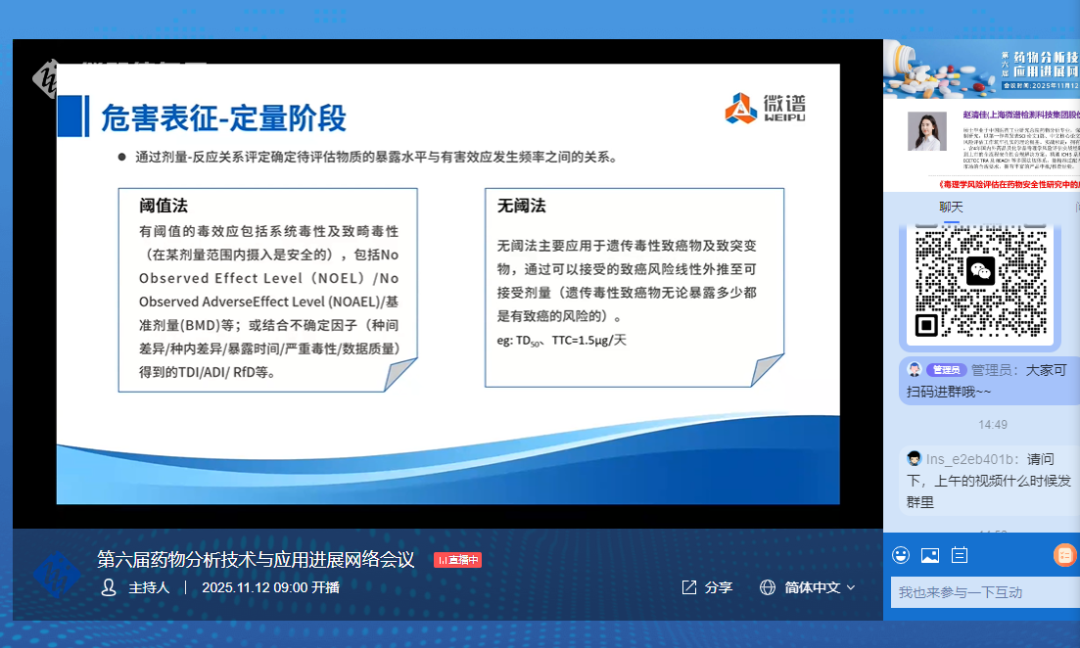
▲ 毒理学风险评估危害表征-定量阶段
2
危害表征-定量阶段
通过剂量-反应关系评定确定待评估物质的暴露水平与有害效应发生频率之间的关系。
阈值法:
有阈值的毒效应包括系统毒性及致畸毒性(在某剂量范围内摄入是安全的),包括No Observed Effect Level(NOEL)/No Observed AdverseEffect Level (NOAEL)/基准剂量(BMD);或结合不确定因子(种间差异/种内差异/暴露时间/严重毒性/数据质量)得到的TDI/ADI/ RfD等。
无阈法
无阈法主要应用于遗传毒性致癌物及致突变物,通过可以接受的致癌风险线性外推至可接受剂量(遗传毒性致癌物无论暴露多少都是有致癌的风险的)。
3
暴露评定
通过定性和定量评价测定待评估物质的暴露程度大小,暴露频率,暴露持续时间和内剂量。
暴露评定通常由四个主要的步骤组成:
确定评定的问题;
选择暴露模型;
收集和评价数据;
暴露表征。
4
风险表征
通过危害识别、危害表征和暴露评定的综合结果提供人体暴露化学物对健康产生有害作用的可能性的估计。
三
毒理学风险评估的应用案例
1
元素杂质PDE评估
计算方法:
①步骤1:从关键研究中选择 NO[A]EL值、 LO[A]EL值或其他POD值;
②步骤2:推导不确定因子F(n);
③步骤3:根据不确定因子和NO[A]EL值、 LO[A]EL值或其他POD值推导PDE值。
计算公式:
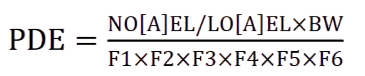
控制策略:
当杂质水平低于控制阈值(30%PDE)时,无需额外控制;
当元素杂质水平超过控制阈值时,需建立控制方法来确保元素杂质水平不超过 PDE 值,根据 ICH Q6A 对元素杂质进行定期检测。
元素杂质水平高于既定PDE的合理性论证:
次因子法(subfactor)
调整修正因子法
调整至与实际更相关的研究等
2
有机杂质评估
残留溶剂:在原料药或辅料的生产中以及制剂制备过程中使用或产生的有机挥发性化合物。
可提取物和浸出物:在既定的生产和标示的储存条件下,从生产组件/系统、包装等迁移到药物制剂中的物质;在特定的实验室检查条件下加严浸提出的物质。
基因毒杂质:已知的致突变致癌物和潜在的致突变致癌物;致突变杂质的鉴别、分类、定性和控制的可行性方案,控制杂质潜在的致癌风险。
毒理学评估守护药品共线生产清洁验证的“科学防线”
3
药品共线生产清洁验证中的HBEL评估
HBEL相较于传统方法,如 1/1000 最低日治疗剂量、10ppm 方法等设定的限度,其可接受标准在评估清洁残留数据时在科学性方面更具优势;
在药品研发阶段收集用于清洁验证的药理、毒理等数据;在技术转移阶段进行清洁确认;药品生产及上市后阶段开展清洁验证和持续清洁工艺确认。
4
儿童用药安全性评估
《儿童用药(化学药品)药学开发指导原则(试行)》提到,应论证儿童制剂中使用特定矫味剂的合理性。尽可能提供矫味剂所有组分的定性和定量组成,还应讨论包括过敏性和致敏性风险在内的安全性问题。
《化学药品仿制药口服溶液剂药学研究技术指导原则》提到,应关注辅料的种类和用量还需符合特定治疗人群的要求,符合相关指导原则要求,例如对于儿童患者,香精类矫味剂中可能含有的乙醇等可能会造成严重的不良反应。
总结来说,毒理学风险评估在药物安全性研究中的应用贯穿药物研发的全流程,是药物研发中不可或缺的环节。它首先应通过危害识别将待评估物质的毒性特征进行定性,之后通过危害表征即剂量-反应关系得到物质的安全阈值或可接受限度,再结合暴露评定最终对待评估物质进行风险表征,从而及时发现和排除潜在的健康风险,以满足各国或地区的法规的要求。
更多详情 · 请联系
电话:021-3178-5055
邮箱:yiyao-marketing@weipugroup.com