专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18


所有应用于人类临床的医学解决方案,在研发和测试阶段都离不开动物实验研究。在生物制品的生物安全研究中,动物实验也是其中不可或缺的重要部分。可是,如果生物安全检定动物体内实验发生变更应该怎么办呢?本期技术共探,我们将带来硬核知识分享!
——生物制品外源因子检测要求:动物体内接种实验


2020年《生物制品注册受理审查指南(第二部分 治疗用生物制品)(试行)》2中3.2.A.2规定,注册申报需要提交“外源性物质的安全性评估资料”,评估资料包括风险评估资料、病毒清除验证研究资料、检测项目与报告、检测方法与验证等资料。对于生物制品的外源因子检测方法要求,可以参考2023年《ICHQ5A (R2)来源于人或动物细胞系生物技术产品的病毒安全性评价》7的指南要求。其中,动物体内接种实验是外源病毒因子检测不可或缺的重要部分。
——中美双报细胞库检定:动物体内接种实验要求

图源 | FDA官网
细胞库作为生物制品表达系统的关键起始原料,对其外源病毒因子的全面检测是各国法规的共识,包括《中国药典》2020版三部生物制品生产检定用动物细胞基质制备及质量控制1、USP General Tests and Assays: <1237> Virology Test Methods6以及中国食品药品检定研究院等发表的《基因治疗产品质量控制概述》5等。
鉴于病毒的感染活性特点,动物体内接种实验能够很好地体现敏感性,所以被各国药典以及指南所要求。如下表1所示,对不同动物类型的体内接种对应敏感病毒种类以及适用产品的范围进行了总结。

表1
——动物体内接种实验:外源病毒因子检测与药物安全性评价
ICHQ5A的附件Table 27非常清晰地向我们展示了病毒的不同检测方法的优点和局限性,包括体内动物接种、体外细胞共培养、抗体生产实验、透射电镜检测、qPCR核酸检测以及逆转录病毒检测等。
虽然动物体内接种能够敏感识别活病毒,但是同时对于病毒检测种类是有限的,可能会形成干扰。在实际实验过程中,实验动物的筛选、饲养环境、人员操作、实验操作等都可能会造成实验结果的偏差。
外源病毒因子动物体内接种实验常见的问题如下表2所示,从而指向样品的阳性结果。
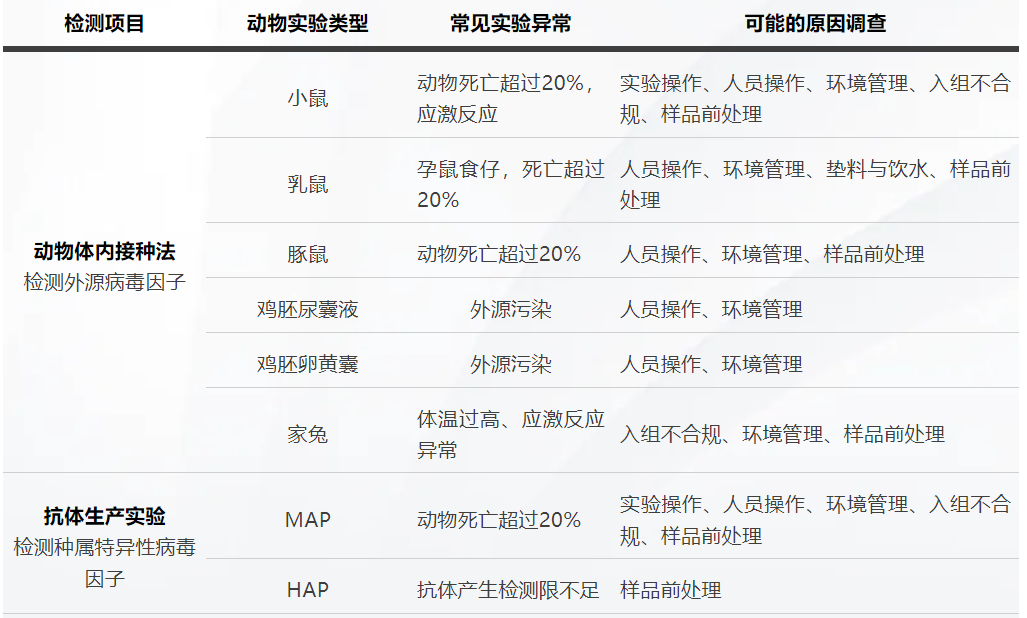
表2
动物实验的影响因素较多,所以在实验设计、动物筛选、实验操作、饲养管理、人员培训等方面都需要全面质控,以降低系统性的累计误差。
动物实验不只是在外源病毒因子的检查方面,对于非临床的动物模型、药理毒理安全评价、药效概念验证等更加重要。2022年6月CDE发布《基于动物法则的药物注册技术指导原则(征求意见稿)》4,以促进药物研究中动物实验的规范性,从而产生更加客观真实的研究结果,更好地指导临床实验。


——生物制品外源因子检定与药物生产工艺变更:动物体内接种实验变更管理
动物实验是指示药物安全性如外源因子的检测方法,同时也是指示药物有效性如效价测定的检测方法。对于动物实验的变更,一直是法规的重点关注对象。如2021年NMPA发布《已上市生物制品药学变更研究技术指导原则(试行)》3,其中将药物活性质量控制方面的动物检测场地变更列为重大变更,需要说明变更理由,详述变更检定场地信息,包括名称(全称)、地址(具体到厂房/车间)和功能等,并且必须提供支持方法学转移的技术资料。


2023年,FDA也发布了行业指南草案《人类细胞和基因治疗产品的生产变化和可比性》8,对于CGT领域产品的变更评估更加严格,特别是符合21CFR第211部分的在研产品和许可产品,需要在严格的质量体系下进行包括动物模型进行的定量研究,以证明产品具有预期的生物效应,并为变更前和变更后产品的可比生物活性提供支持性证据。

来源:FDA《人类细胞和基因治疗产品的生产变化和可比性》
——CNAS管理体系:动物体内实验变更管理
目前对于细胞库检定中的动物体内接种检测实验,监管处于真空状态,基本依据创新药供应商审计管理。委外检测项目中的委外动物实验,发生变更的风险会越来越高,尤其是发生场地变更等情况。
考虑到动物实验的影响性,尤其是安全性指标的检定,一旦发生场地变更,需要参照上市后生物制品的变更进行管理。至少需要考虑动物实验变更后的厂房设施验证、实验设备的转移验证、实验方法的转移验证、人员的再培训,对既往项目的数据管理、现场管理留存等。并且按照质量管理体系的要求需要主动告知既往项目客户,做好相关变更必要性的说明和全面验证,并准备客户的补充质量审计。

来源:CNAS官网
参考资料:
1. 2020.中国药典2020版三部:生物制品生产检定用动物细胞基质制备及质量控制.
2. 2020.NMPA.生物制品注册受理审查指南(第二部分治疗用生物制品)(试行).
3. 2021.NMPA.已上市生物制品药学变更研究技术指导原则(试行).
4. 2022.CDE.基于动物法则的药物注册技术指导原则(征求意见稿).
5. 2023.中国食品药品检定研究院等. 基因治疗产品质量控制概述.中国药事.
6. 2012. USP General Tests and Assays: <1237> Virology Test Methods.
7. 2023. ICH Q5A(R2).Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin.
8. 2023. FDA. Draft Guidance for Industry: Manufacturing Changes and Comparability for Human Cellular and Gene Therapy Products.
9. 2018. CNAS-CL01:2018《检测和校准实验室能力认可准则》.