专家解读 | CHO重组表达产品上市申报前遗传稳定性研究要求
2024/12/18

由Smithers主办2023年E&L亚洲年会于12月5-6日在上海圆满举办。微谱医疗器械高级技术总监汪衡老师受邀作为专家团成员深度参会,并在首日发表《不同浸提条件/浸提方式下的可浸提物/可沥滤物的比较研究》专题演讲,吸引了的现场100余位观众的热情关注与积极反馈。

▲ 汪衡老师在2023年E&L亚洲年会首日演讲
演讲精华回顾
可浸提物与可沥滤物研究一般流程
医疗器械化学表征中可浸提物与可沥滤物研究的一般流程分为以下两个部分内容:
一是材料表征,通过光谱法、质谱法、色谱法等表征医疗器械材料化学结构与组成及物理特性等;二是E&L研究,可以表征从医疗器械产品中释放出的可浸提物和或可沥滤物,在形成完整的化学表征研究资料之后支持产品的生物安全性评价工作。
如何选择进行可浸提物研究或可沥滤物研究,是很多器械企业常常关注的内容。
在针对医疗器械产品的实际研究中,具体应该怎样选择呢?建议可以从两个维度考虑:一是基于对于可浸提物结果的预测,如果该结果预期不会过于严苛,则优先进行可浸提物研究;二是,如果可沥滤物研究在实际执行过程中相对较便利且能够覆盖临床风险,可优先选择可沥滤物研究。
围绕以上两个维度,在方案设计之前需要先收集更多信息,包括产品的材料组成及临床使用方式,如接触途径、接触方式、接触频率、使用个数等。基于以上信息并结合试验目的,最终形成合适的浸提条件。
多种多样的浸提条件与浸提方式
在10993-18以及10993-12中已经对整个浸提实验的设计框架有明确的表述。影响浸提条件的参数大概大致分为三类:一是浸提比例,二是浸提溶剂,三是浸提方式。
关于浸提比例,业内已经有普遍共识,即优先考虑表面积法,其次在收集不到样品表面积时考虑重量法。
关于浸提溶剂,需要基于不同的产品类型进行判断。短期接触医疗器械可以使用单一的浸提溶剂,长期持久接触的医疗器械则要考虑不少于3种浸提溶剂。
至于浸提方式,我们可选择的有加严、极限、模拟、加速。其本质是通过浸提时间、温度、流速等的改变调节出合适的条件。
影响溶剂筛选的一个重要因素是材料。医疗器械的材料可以分为合成高分子、天然高分子、金属、陶瓷、动物源组织等。往往会影响溶剂筛选的是合成高分子材料。
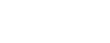
不同浸提溶剂下浸泡医疗器材料,会导致浸提释放物质无论个数还是种类,都可能有非常大的差异。根据相似相溶原理,⼀般情况下,我们会优先考虑浸提媒介的极性和器械材质的极性(如下文献所述)。
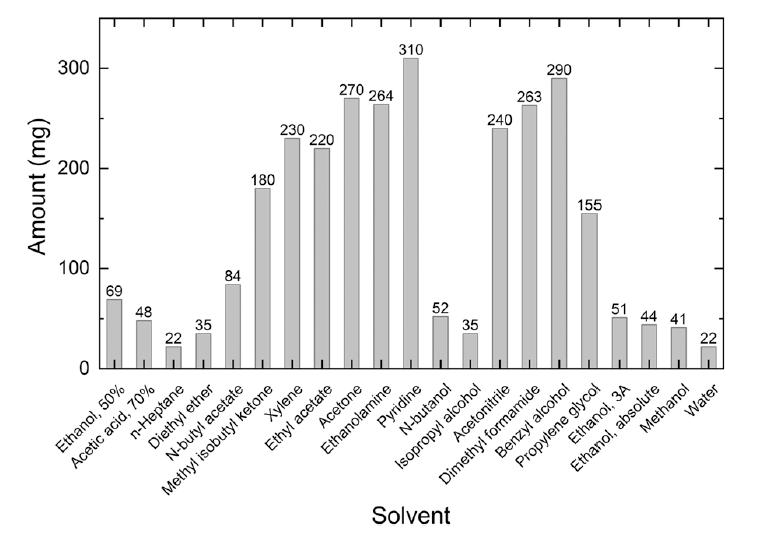
▲ Journal of Pharmaceutical and Biomedical Analysis 222 (2023) 115081
综上所述,微谱创造性地将医疗器械产品按照产品分类、接触时间、临床接触场景等做了进一步的区别,根据医疗器械的分类目录区分样品不同的材质及不同的使用场景,细化出应该如何设计相对应的浸提条件,形成了微谱医疗器械浸提手册。
精选案例分享与解析
汪老师基于调整浸提时间、浸提方式、释放动力学三种维度进行了案例分析。
案例一:关于模拟使用与加速提取的研究。产品是一款一次性便携式输液产品,产品临床使用时间是小于120个小时。正常情况下,我们只需要模拟产品的正常使用并监测其中的物质成分即可。但在实验中,我们选择了加速提取,参考ASTM F1980-21根据加速公式设计方案,取得了比较理想的结果并最终满足了监管的需求。
案例二:有关总量和最大释放量的研究。产品是可降解类器械,需要考虑它的释放量。通过极限浸提试验会发现其释放量是一个缓慢降解而达不到极限浸提的过程。根据这个试验的特点,我们将浸提时间调整为24小时,连续测试单日释放量,基于单日最大释放量进行安全性评估。
演讲的最后,汪衡老师强调可浸提物/可沥滤物研究是化学表征研究中最便捷有效的手段之一。不同于药包材相容性研究,医疗器械的E&L研究并没有明显的界限,可浸提物与已知可沥滤物研究是目前研究的主流。目前,浸提液测试方法的标准化正在快速推进,未来将更好地支持医疗器械的生物学评价工作。

▲微谱演讲吸引现场嘉宾关注
演讲老师介绍

汪衡
微谱医疗器械事业部高级技术总监
汪衡先生现任微谱医疗器械事业部高级技术总监,中国食品药品企业质量安全促进会医疗器械分会首批专家库成员,领导建立了微谱百万级谱图数据库医疗器械数据库。他在医疗器械化学表征、药物相容性研究、体外降解试验以及各项理化性能检测等方面具有丰富的项目实践经验。所领导的实验室团队已经服务超过1000家医疗器械生产企业,其中绝大多数为高风险医疗器械厂商。协助骨科植入物、心血管植介入器械、神经外科植介入器械、眼科植入器械、血液净化耗材、输注器具等多款高风险医疗器械成功完成不同监管机构的注册申报。
—— END ——