技术共探丨关于USP对照品,你了解多少?
2022/06/07


10月13日,聚焦研发 闪“薬”未来 │2023年生物药技术交流沙龙—成都站,微谱生物制品研究中心高级技术总监黄卓老师带来了《新型生物制品质量研究策略》专题分享,吸引了参会观众的全程关注与积极互动。

新型生物制品
质量研究策略

—
黄卓
微谱生物制品CMC研究中心高级技术总监
▊个人简介:曾任职于药明生物、复星医药。十余年深耕生物制品质量研究领域,尤其是拥有单抗、融合蛋白、ADC类等生物制品的质量研究经验。曾作为核心成员先后完成西妥昔单抗、EPO-HyFc、IL4纳米抗体的成功获批,曾深度参与诸多生物制品的CMC项目管理,并拥有将其由临床前推动至临床及上市阶段的丰富经验,整体负责蛋白类、mRNA、AAV、ADC、疫苗及佐剂、细胞治疗等质量研究平台。
一
生物制品的现状
生物制品主要是指以微生物(细菌、病毒等)、动植物成分为原料,通过生物技术( 基因工程、细胞工程、蛋白质工程和发酵工程等)生产出来的,用于人和动物的疾病预防、治疗和诊断用的产品。其主要分为三类:治疗用生物制品,包括单抗、双抗、融合蛋白、ADC偶联抗体、多肽、溶瘤病毒载体类、Car-T/NK、间充质干细胞等;预防用生物制品,包括灭活疫苗、减毒疫苗、结合疫苗、腺病毒载体疫苗、mRNA疫苗等;诊断用生物制品,即新冠、流感病毒检测试剂盒等。

近些年,随着传统多肽、单抗等生物制品已不能完全满足现有临床的需求,市场上逐渐涌现出越来越多的各类新型生物制品,如双抗、mRNA疫苗、ADC、溶瘤病毒、Car-T/NK、AAV、干细胞、外泌体等细胞治疗和基因修饰产品等。
纵观2022年CDE审评报告,药品注册申报领域存在的主要问题有:1、研发立题方面,立题依据和背景不够充分,临床定位不清,适应症选择不合理,成药性评估不足等;2、有效性方面,已有临床数据尚无法证明品种有效性;3、安全性方面,临床前安全性研究方法或者质量控制问题,或研究数据不充分,不足以支持后续临床开发;4、质量可控性方面,药学研究存在严重缺陷,无法证明产品的质量可控性;5、其他方面,注册核查中发现产品质量的重大缺陷,注册核查抽样检测不合格等。
二
新型生物制品质量研究策略
2.1 单抗和ADC药物
从两类药物的技术指导原则来看,单抗和ADC药物的质量研究都可以参考《人用重组DNA蛋白制品总论》、《人用单克隆抗体质量控制技术指导原则》以及ICH相关指导原则。ADC还可以参考《抗体偶联药物药学研究与评价技术指导原则(征求意见稿)》,因为ADC药物含有小分子的属性,还可以参考《化学药物原料药制备和结构确证研究的技术指导原则》等。
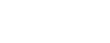
对比单抗和ADC药物的基本信息,可将其主要差异罗列如下,供大家参考:
跟单抗相比,ADC的质量研究策略差异主要体现在以下三个方面:一、从质量控制策略上看,ADC相比单抗采用大、小分子单独研究却又有机统一的质量控制体系。在实际操作中,ADC的质量控制策略又大部分是沿用单抗的质量控制策略来开展的。二、从质量属性来讲,ADC相比单抗还需要增加对连接子和毒素小分子质量控制,也包括偶联位点、DAR值、载药分布、杂质控制等方面的指标分析。三、从检测方法差异来看,由于ADC分子的复杂性,它在质谱分析中常进行去糖基化或羧肽酶B的样品前处理,以降低ADC药物的复杂性;IEX-HPLC一般无法用于ADC电荷异质性分析;消光系数需考虑偶联分子紫外吸收的影响;而且蛋白浓度测定一般使用一次性的比色皿,避免毒素累积等。另外,由于ADC药物的特殊性,也需注意操作人员的职业暴露风险。
单抗和ADC从结构上看是存在一定相似性的,都需要从一级结构、高级结构、理化性质、免疫学特性与生物学活性以及其他性质开展相关研究,但ADC
还需对偶联部分的质量属性进行充分的研究和控制。
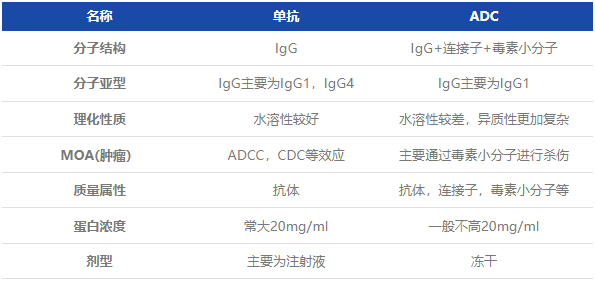
从杂质控制维度来看,主要差异对比如下表:
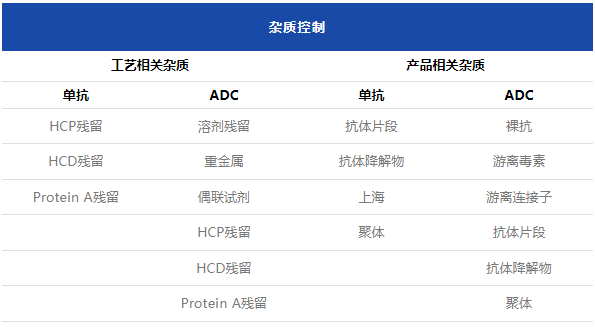
随后,黄老师对单抗和ADC药物的质量控制的检项及其关键要点进行了对比说明。他强调,生产工艺和分子设计的不同往往决定了其质量控制策略上的差异。
2.2 AAV和LNP递送药物
AAV和LNP是目前市场上应用比较广泛的药物递送系统,它们在递送原理和分子构造上也存在很多的可比性。
从开发指导原则上看,AAV和LNP都可以参考《人用基因治疗制品总论》和《体内基因治疗产品药学研究与评价技术指导原则》。此外AAV还可以参考
《腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则 》等,LNP可以参考《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)》和《Analytical Procedures for mRNA Vaccine Quality》等。
从基本信息来看,大致差异对比如下表:

整体来说,AAV和mRNA均从核酸、递送材质、颗粒体三个不同水平开展结构分析,但应结合各自的生产工艺和结构特点开展相应的质量研究。


▲微谱生物制品质量研究实验室
三
疫苗类生物制品质量研究策略
3.1 预防人用疫苗-结合疫苗
预防人用疫苗的相关指导原则比较多,《中国药典》、CDE等都已经给出相关参考。从行业分类来看,疫苗一般可以分为6种:灭活疫苗、减毒疫苗、亚单位疫苗、基因工程重组蛋白疫苗、结合疫苗以及联合疫苗。
黄老师以破伤风毒素蛋白(TT)疫苗为例进行了质量特性研究分析。破 伤 风 毒 素 蛋 白是结合疫苗比较常用的一种载体蛋白,其特性分析往往要结合重组蛋白的特性开展。以TT为例,需要从鉴别、物理性质、含量分析、纯度分析、结构分析、工艺杂质及安全检定等方面进行研究,当然也有一些对应的法规进行参考。
3.2 疫苗检测用试剂对照品的溶液稳定性
《药品生产质量管理规范》和《疫苗管理法》都明确提到了要加强药然品和疫苗的质量管理,以确保药品的安全性、有效性和质量可控性。然而对于疫苗中间体和放行检测方法中存在很多企业自己配制的试剂对照品溶液(例如:氯化乙酰胆碱) ,其溶液有效期的选择往往缺乏制定依据,无法保障检测结果的准确性。微谱针对这类需求也有自己的稳定性解决方案。
四
生物制品中相关杂质研究策略
ICH Q6B中对杂质有相关介绍,分为两类:1是产品相关杂质;二是工艺相关杂质。工艺相关杂质是指生产过程中产生的杂质或下游工艺产生的杂质。
相关指导原则有ICH系列如Q2(R1) :分析方法论证:正文和方法学;Q3C(R8) :杂质: 残留溶剂的指导原则;Q3D(R2) :元素杂质指导原则;Q6B:质量规格:生物技术/生物产品的检验程序和可接受标准;以及中国药典第四部 通则9306 《遗传毒性杂质控制指导原则》等。
随后,黄老师列举了生物制品中常见工艺相关杂质,如抗体类、AAV类、ADC抗体偶联类、mRNA类等。可以看到,各品种的杂质还是有很大不同,比如说ADC类在化学小分子、溶剂残留以及还原剂上会有不同;AAV类在筛选剂和转染剂上会有一些差别;mRNA类则在核酸及核酸酶类杂质上会有一些区别。
黄老师强调,生物制品的质量研究应基于各品种的特点,并充分结合其分子特性和生产工艺的不同,分别从鉴别、结构分析、含量、纯度、杂质、活性和安全性等多方面开展质量研究,并建立全生命周期的质量控制体系,从而达到保障药品安全性、有效性和质量可控性的目的。

最后,黄卓老师的专业演讲在与现场观众的问答互动与热烈讨论中走近尾声,这也是聚焦研发 闪“薬”未来 │2023年生物药技术交流沙龙—成都站的第二场精彩分享。
关注微谱生物科技公众号,更多行业动态,硬核干货,持续分享!
关于我们
微谱于2014年正式涉足生物制品服务领域,2021年成立微谱生物科技有限公司,成为集团在生物药领域的重要战略布局。2022年公司荣获“江苏省民营科技企业”称号。
微谱生物科技立足于生物医药全产业链,依托创新型自主知识产权体系构建出成熟的生物制品质量研究平台、生物安全服务平台、GMP验证及法规咨询服务平台、药包材研究服务平台以及药械知识产权服务平台,致力于为国内外生物药企业提供合规、专业、一体化的生物制品质量与安全研究综合解决方案。
