技术共探丨关于USP对照品,你了解多少?
2022/06/07


10月13日,聚焦研发 闪“薬”未来 │2023年生物药技术交流沙龙—成都站现场,微谱生物科技CEO杨佳佳作为沙龙的首位演讲嘉宾,为现场80余位参会嘉宾带来了《生物技术产品生物安全风险控制策略》专题演讲。

生物技术产品生物安全
风险控制策略

—
杨佳佳
微谱生物科技CEO
▊个人简介:药品研究领域CMA、CNAS授权签字人,中国医药生物技术协会专家库专家。拥有10余年药物质量及生物安全研究丰富经验,并熟稔相关国内外法规与要求。聚焦细胞库检定、病毒清除验证、病毒检测方法研究等领域,凭借前沿性的研究思路与锐意进取的科研理念,累计项目经验达1000余个。多篇药物质量、药物载体分析研究相关论文被收录进Chem. Commun.、Dalton Trans、Supramolecular Chemistry等国际知名期刊,总影响因子超过16。还曾屡屡受邀出席国内外行业高峰论坛并发表主题演讲,并持续在药物质量及生物安全研究的前沿进行知识分享。
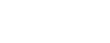
一、中美申报的差异
中外法规中有关生物安全研究的要求,简单列举来看,国外的有ICH、WHO、欧盟、FDA等,国内的有《中国药典》以及CDE发布的一系列针对不同品种、不同阶段和不同环节的技术指导原则等。

▲ 指导原则
中外申报因为法规差异会导致执行规范与方案的差异。以中美双报为例,就存在质量体系、应检机构、物料、检测对象、方法以及监管理念等多维度的差异。总的来说,FDA对于IND申报,重点关注安全性问题,NMPA对于IND阶段把控较为严格,在实际申报中企业应该更全面地进行风险评估,其监管理念也越来越接近ICH和FDA的理念。
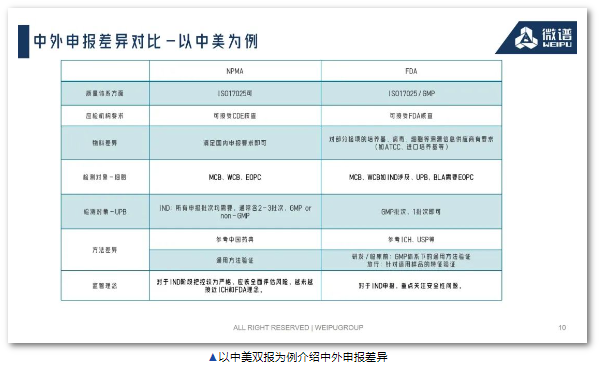
二、生物安全的关键控制点
首先,我们需要明确下生物安全的总控制策略。由于方法的局限性及企业质量控制策略的差异等,病毒未检出并不能代表产品无病毒安全风险。实际上,想要保障产品的生物安全,需要多维度综合考虑,如源头物料是否已经排除了生物安全危害?物料投入产线后工艺是否有引入风险,且引入风险后是否有能力去除?在适当的生产步骤测试产品是否无污染性传染性病毒?
2.1 关键物料控制
制造商应尽可能避免在其制造工艺中使用人和动物来源的原材料(如人血清、牛血清、猪胰蛋白酶)。如果无法做到这一点,使用动物源性原材料时,应提供与风险相称的相关文件或材料资格证明。应提供材料制造工艺中使用的来源国、来源组织、病毒灭活或去除步骤以及对原材料进行的病毒检测类型等信息。
为了满足不同客户不同项目的需求,微谱生物安全服务平台目前在物料控制培养基、血清等方面的检测能力包括:
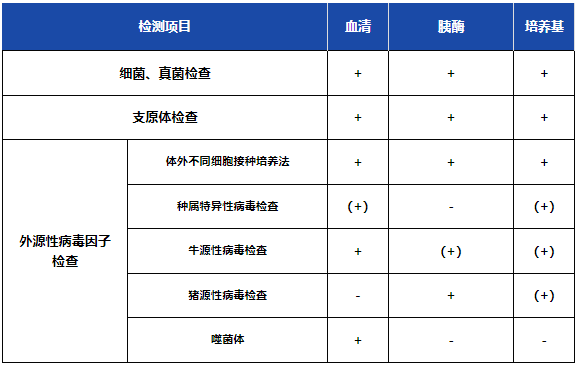
2.2 细胞库及UPB控制
细胞库和UPB是尤为重要的关键环节。细胞库控制策略中有诸多需要考虑的因素,如微生物污染、CHO细胞和种属细胞的污染、内外源性病毒、目标基因组是否丢失或足量稳定存在等等。
从国内外法规策略来看,ChP、FDA和ICH各提出的相关要求整体比较相近,以《中国药典》为例,具体要求如下:
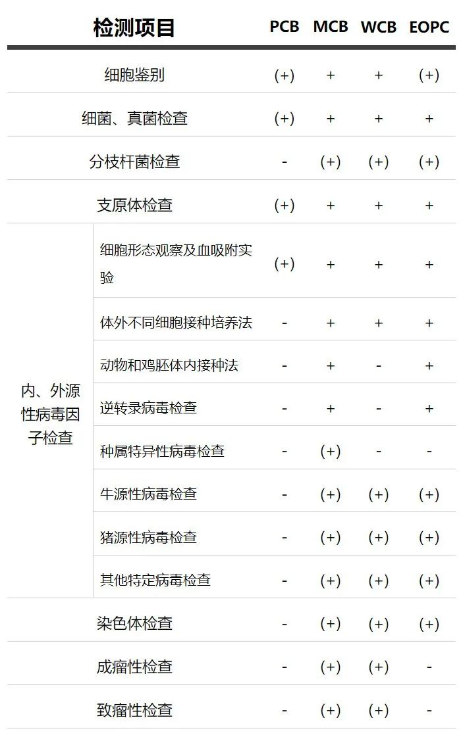
“+”为必检项目,“-”为非强制检定项目,“(+)”表示需要根据细胞特性、传代历史、培养过程等选择检定项目。
▲《中国药典》2020年版三部生物制品通则-生物制品生产检定用动物细胞基质制备及质量控制
随后,杨老师基于当前的法规现状,以293T国内申报和CHO细胞的中美申报为例进行了真实案例分享。
针对UPB检测,建议制造商制定工艺,持续评估生产批次中的外源病毒。应通过考虑几个因素来确定对UPB进行病毒检测的范围和程度,这些因素包括:用于生产所需产品的细胞系的性质;细胞库检定的病毒检测结果;培养方法、原材料和试剂来源;病毒清除研究的结果等。
如果在UPB阶段检测到任何外来病毒,除非有正当理由,否则不得将收获物用于产品生产。对于连续的生产工艺,最终子批次的放行要求在当批次收获液记录无病毒污染。
2.3 工艺控制
在通过参照指南对比参数,进行前期研究确认工艺有效后,如何客观表征工艺能力呢?一是实验病毒滴度要高,一个有效的病毒去除步骤通常会在至少两个独立的研究中显示,LRV可重现地≥4 log。二是实验病毒纯度要高,微谱生物安全实验室通过TFF切向流纯化、膜层析/复合填料层析以及超高速离心等组合研发获得了高纯度的病毒,且在质控合格后才会投入正式试验。
在工艺控制环节,提出符合法规要求的研究方案是重中之重。此外,微谱还有齐全的方法(qPCR、TCID50、Plaque assay)并且经过验证、设备符合GMP/ISO双质量体系要求、指示病毒种类齐全且滴度纯度均达标、覆盖工艺过程齐全、实施中定期项目汇报、周期更短等服务优势。
三、质量体系保障
微谱生物安全服务平台的差异化布局体现在我们聚焦国内客户的中外多报。

▲微谱生物安全实验室
从细胞和病毒的采购流程到质控放行,我们均有体系化的质量保障。微谱生物科技拥有CMA、CNAS、ISO、P2生物安全实验室等各类证书,我们的质量体系从人、机、料、法、环各个环节严格按照GMP要求以确保数据完整性,能够为客户项目提供合规运营的基本保障,满足FDA和欧盟的严格要求。
演讲的最后,杨老师还分享了我们在中美双报方向的3个实践案例,进一步剖析了生物安全的控制策略关键要点。

杨老师的精彩分享吸引了现场80余位参会嘉宾的全程关注。随后的Q&A环节中,演讲老师与提问嘉宾也进行了专业的问答互动与技术交流,这成为本场 聚焦研发 闪“薬”未来 │2023年生物药技术交流沙龙—成都站 活动中难忘的精彩瞬间!
关注微谱生物医药技术服务公众号,更多行业动态,硬核干货,持续分享!
关于我们
微谱在生物医药领域致力于成为您值得信赖的医药研发伙伴。我们密切关注全球生物医药行业发展趋势,立足药物及医疗器械实验室服务全产业价值链,以完备的质量体系、高速的交付周期、丰富的项目经验及持续扩张的能力布局,为行业提供契合全生命周期的化学药、生物制品、医疗器械的研发及相关实验室服务,法规咨询与合规验证,药学CMC,临床医学研究等。我们的服务得到了中国、欧盟、美国、WHO等国际主要市场监管机构的认可,成功助力3000余家医药、医疗器械企业加速产品上市进程!
