一. 项目简介
1. FDA 工厂注册简介 FDA 工厂注册,即“Establishment Registration”,又叫场地注册。产品登记,即“Listing”。
根据美国联邦食品药品化妆品管理法和美国联邦法规相关要求,任何从事药品生产和包装活动的企业必须将其生产地址 与产品在 FDA 登记。此项要求对美国本土企业和海外企业同样适用。
对于海外企业,工厂注册和产品登记是美国 FDA 对进口药品的重要监管措施之一。FDA 可以通过注册号第一时间查到 相关企业的详细信息,并可及时联系相关企业在美国的代理人,有效掌握相关企业产品在美信息。
自 2009 年 6 月 1 日起,FDA 不再接受纸质的工厂注册和产品登记,而一律采用电子方式进行注册登记。
2. FDA 工厂自认定简介
FDA 工厂自认定,即“Facility Self-identification”,是根据 FDA在 2012 年10月颁布执行的仿制药用户收费修正案(Generic Drug User Fee Amendments of 2012,简称 GDUFA)中的相关要求,对仿制药药品生产企业执行的一项工厂备案及收费项目。
GDUFA 旨在加快仿制药的审批程序,更高效的为用户提供安全有效的仿制药。GDUFA 要求由药厂承担在仿制药审评和 现场检查所发生的费用。这些费用将有助于 FDA 减少申请审评时间和申请审评滞后的问题,降低药品审评的平均周期, 增加基于风险评估的现场审计。
FDA 工厂自认定需要递交工厂的基本信息,如工厂名称、地址、联系方式、联系人信息、FEI 登记号、D-U-N-S 号等。 这些信息需要用 FDA 指定的 SPL 表格填写完成,再通过 FDA 电子通路完成递交。完成递交后,系统自动验证表格的准 确性,并由 FDA 更新至 GDUFA 数据库。
FDA 工厂自认定需要缴纳场地费(Facility Fee),如不能及时缴纳,将会引起一系列后果。
3. NDC 申请简介
NDC,是“National Drug Code”的简称,译为“国家药品代码”,是药品作为普通商品的识别符号。NDC 数据库可公开查 询,它包括了所有,但不包括兽药、血液制品和非最终上市的药品,如原料药(API)。
任何药品在美国上市前必须申请并登记 NDC 号,登记的主要信息包括药品名称、生产商、药品分类、给药途径、上市 日期、OTC 专论号和标签等信息。具有 NDC 号的药品在符合 FDA 相关药品管理法的基础上可在美国上市,销售商和终 端用户可以根据此号码查询到产品的有关功效和特点,同时 FDA 也根据此号码对产品进行管理。
获得了 NDC 号,仅代表药品信息进入了 FDA 登记系统,但是,在 NDC 数据库登记的产品并不意味着该药品被 FDA 批 准或可作为药物销售,也不意味着这个产品可以享受医疗报销或由其他组织承担费用。
但是,NDC 登记是中国通过 FDA 认证的快捷申请形式。对于收载于 OTC 专论中的药品,在美国上市前无需审批,仅需 按照相关要求提供进行 NDC 登记的必要信息。通过 NDC 登记的中药可在中西药房销售。因此,NDC 登记是中药进入 美国的一条很好的途径。
二. 服务内容
根据美国 FDA 关于电子注册与电子提交的新要求,咨询提供有关 FDA 电子注册与电子提交的全套服务。
服务内容包括:代理 DUNS 号申请;代理工厂识别号(FEI, Facility Establishment Identifier)申请、代理 NDC 登记与维 护,代理 DMF 文件 e-CTD 递交与维护等。
三. 项目流程
通用流程如下:
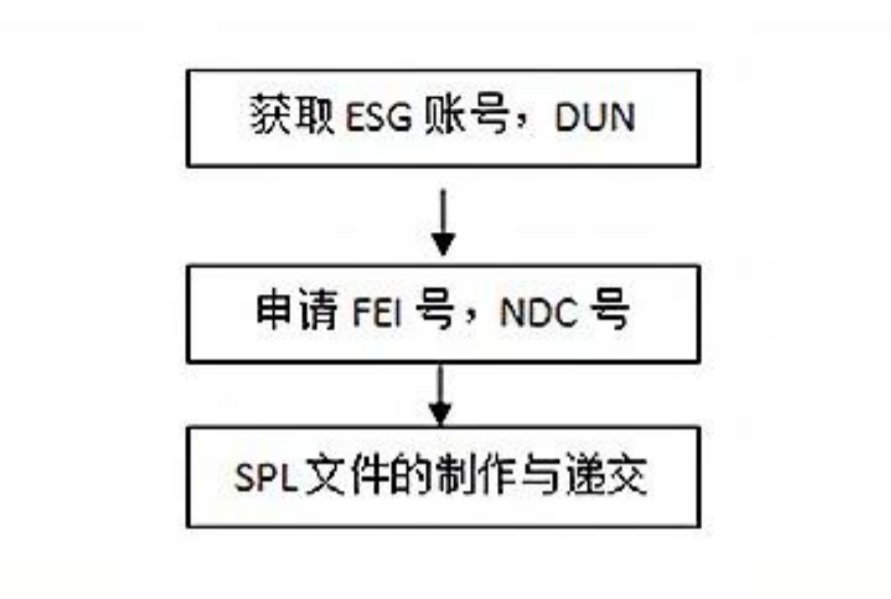
ESG:全称为“Electronic Submission Gateway”,是进行电子递交的通路;
DUNS 号:即 D-U-N-S 码,也叫“邓白氏码”、“邓氏全球编码”,是一个 9 位数字编码,为全球企业用以识别、组织及链 接全球企业家族机构的标准;
FEI 号:全称为“Facility Establishment Identifier”,通常译为“工厂识别号”,是 FDA 用来识别企业的号码;
SPL:全称为“Structured Product Labeling”,是 FDA 在工厂注册及药品登记时所应用的标准。