一、服务范围
提供原料药、原料药中间体、包装材料、辅料等产品在美国的 DMF 首次申报、缺陷答复(直至通过 FDA 审评)、DMF 增补(行政和/或质量变更)、年度报告等服务。
二、服务内容
贯穿DMF整个生命周期的服务:
(1)提供DMF的基础培训,包括美国DMF的介绍、管理制度等;
(2)提供中文DMF编写大纲,负责对中文DMF进行差距分析、风险评估和法规指导;
(3)负责编写英文DMF,制作eCTD格式文件,及ESG递交申报资料至FDA;
(4)提供DMF申报的美国代理服务;
(5)提供建立ESG递交通道的服务;
(6)提供审评过程中与FDA的技术联络及问题答复的服务;
(7)提供已有DMF通过完整性审评和技术审评的服务;
(8)提供已有DMF提交增补、年度报告的服务;
(9)提供激活或关闭DMF的服务;
(10)如有需要,可协助GMP部门为现场核查提供服务。
三、美国 DMF 简介
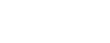
DMF 是“Drug Master File”的简称,一般译为“药品主文件”,是关于产品化学、生产和质量控制信息(CMC, Chemistry, Manufacturing and Controls)的一套完整 CTD 格式的文件资料。目前,DMF 分为四类,具体如下:
FDA 建立 DMF 归档制度,允许原料药、辅料和包装容器生产商以持有人身份,将所需保密的技术信息以 DMF 的形式 直接提供给 FDA,以消除泄密的顾虑。而制剂生产商可通过引用 DMF 归档号来代替制剂申请资料中本应该包含的原料 药、辅料和包装容器的技术信息,简化制剂申请的内容。
DMF 有以下两种状态,决定了 DMF 能否直接被制剂申请所引用:
| DMF 状态 | 含义 | 是否可被引用 |
| “A”=Active | 激活状态,表示该 DMF 已获得归档号并被正常维护 | 是 |
| “I”=Inactive | 未激活状态,表示该 DMF 已被持有人或 FDA 关闭 | 否 |
美国 DMF 没有批准一说。FDA 会在审评引用了 DMF 的制剂申请(例如 NDA、ANDA、IND、BLA)时审查 DMF 的技 术内容,以支持其特定用途。
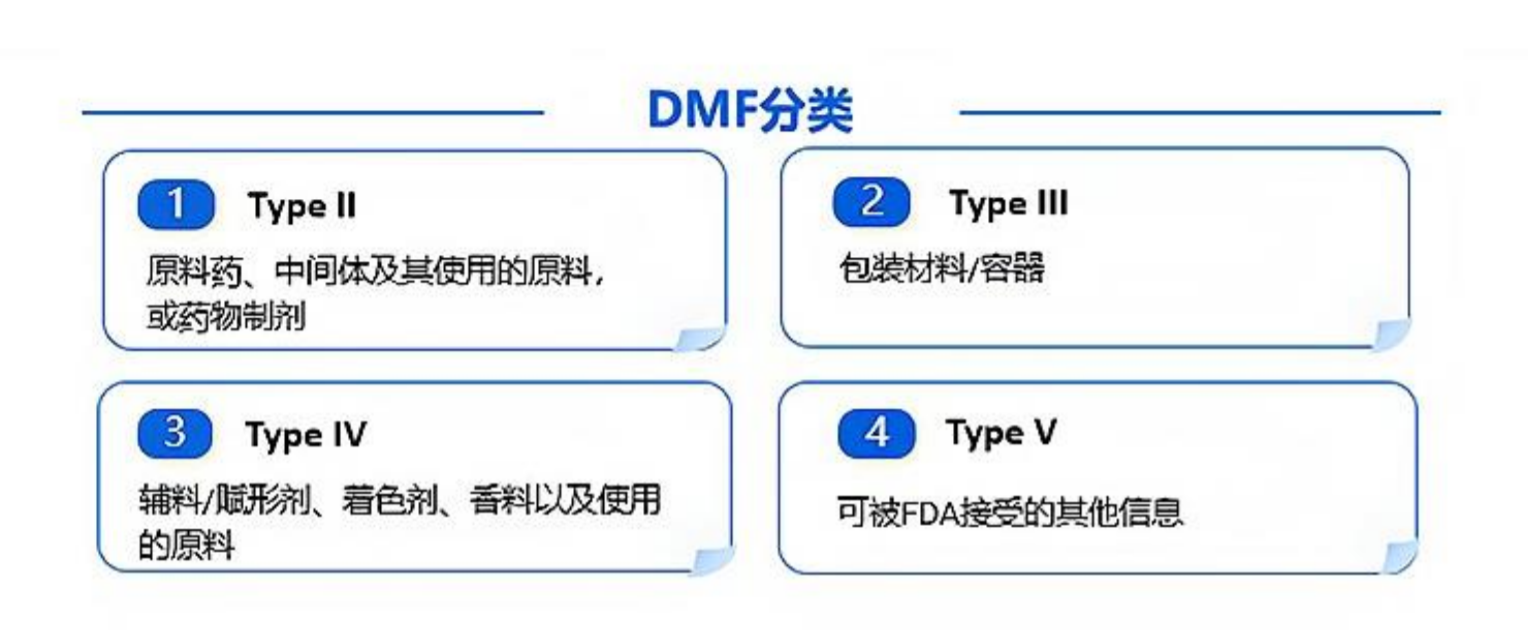
四、美国 DMF 注册流程
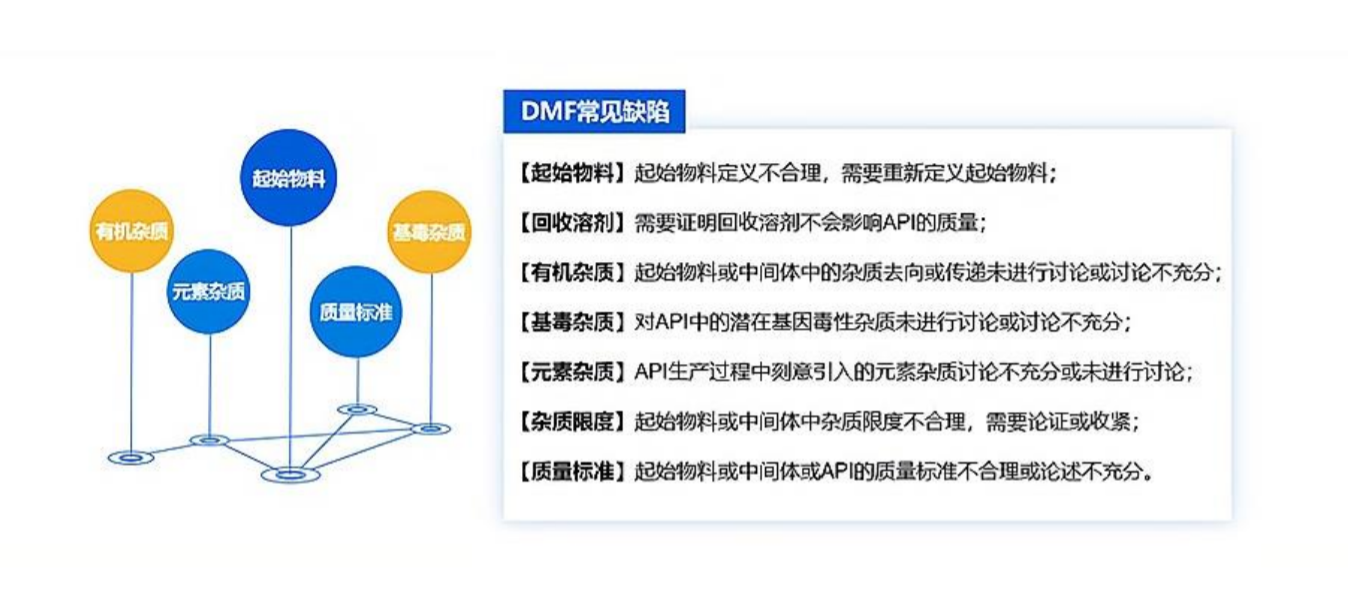
五、美国 DMF 常见缺陷