一、服务范围
提供仿制药在美国的 ANDA 首次申报、缺陷答复(直至获批)、ANDA 变更及年报维护等服务。
二、服务内容
申报前
(1)在前期项目立项过程中,调研、评估分析ANDA注册的可行性
(2)在项目研发过程中,提供专业的技术、法规和现场支持
(3)美国cGMP符合性检查与指导、协助客户完成整改
(4)申报资料的翻译和撰写(除BE外),保证申报资料符合ANDA注册要求
(5)eCTD文件的制作
申报
(1)提供FEI/DUNS/NDC号申请的服务;提供美国代理人服务
(2)提供建立ESG递交通道的服务;负责通过ESG通道递交资料至FDA
(3)负责与官方的技术联络,跟踪审评进度,指导发补回复直至获批
(4)为FDA cGMP现场检查提供翻译以及技术支持
申报后
(1)产品获批后的变更维护服务(AR,CBE,CBE30及PAS)
(2)产品获批后年报编写及递交服务
(3)产品获批后的不良反应报告编写及递交服务
三、美国 ANDA 简介
简略新药申请(Abbreviated New Drug Application)简称ANDA。根据美国《食品、药品和化妆品法》(FD&C Act)及美国联邦管理法21 CFR Part 314,专利期过后的通用名药均按此程序申请上市,一般不需要递交临床前及临床数据来证明安全性和有效性。
拟向FDA递交申请ANDA的药品需符合以下条件:
-应为已被FDA批准上市的,在《经治疗等同性评价批准的药品(橙皮书)》中收载并制定参比制剂的药品;
-其活性成分、剂型、规格、给药途径、适应症必须与参比制剂相同;
-必须与参比制剂具有生物等效性;
-必须按照美国联邦管理法21CFR遵行药品生产管理规范控制生产过程。
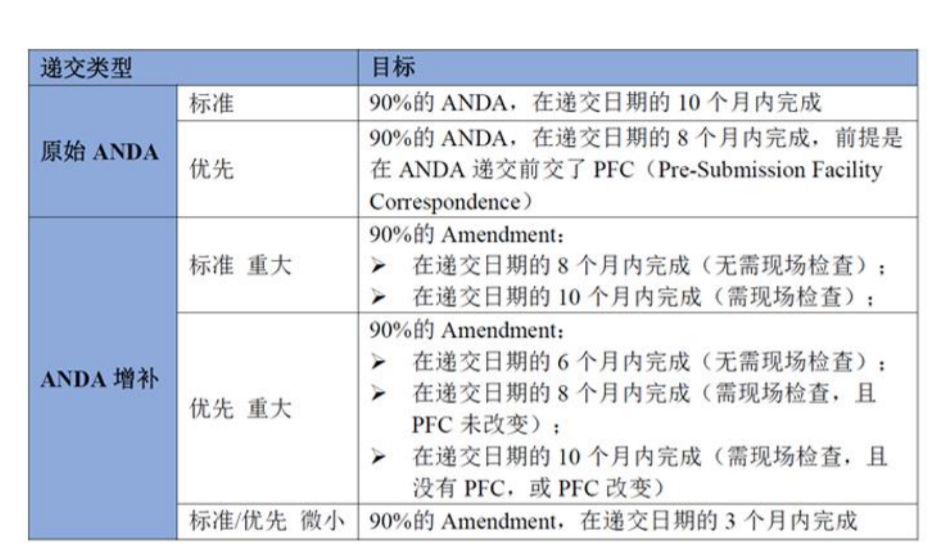
四、美国 ANDA 的申报内容

五、美国 ANDA 注册审评流程
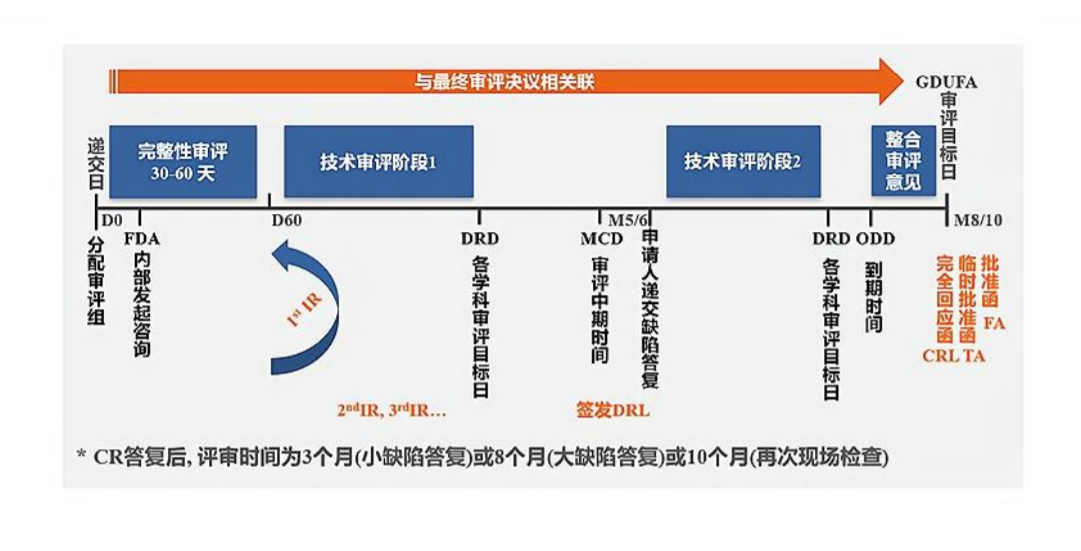
六、美国 ANDA 的技术审评目标