一、服务范围
为美国新药申请(New Drug Application,NDA)及后续维护提供专业的、全生命周期的注册、GMP 咨询服务。
二、 服务内容
(1)提供美国注册代理服务;
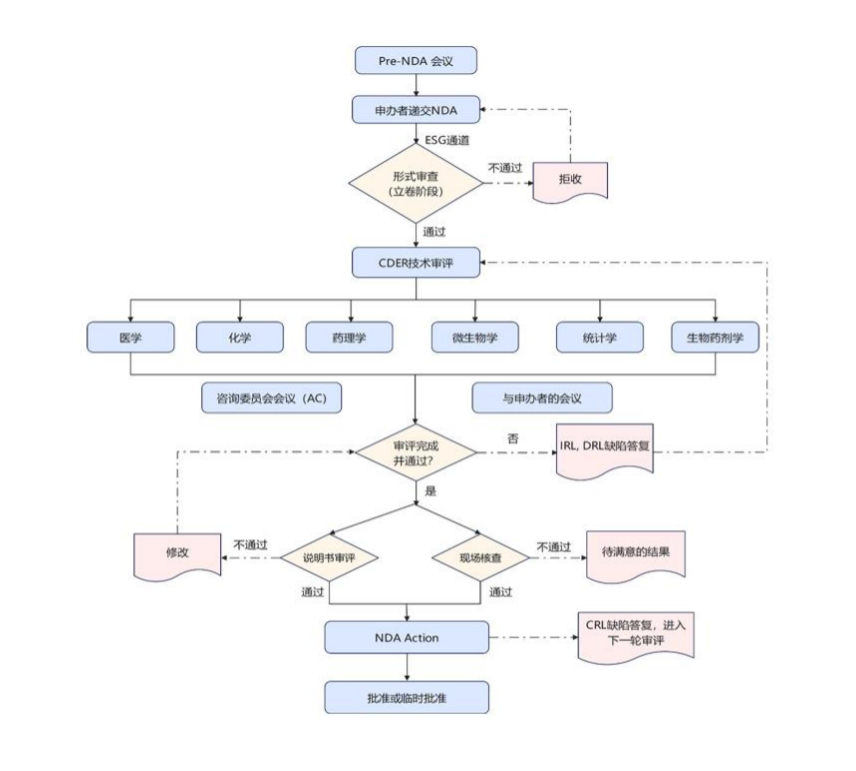
(2)提供Pre-NDA会议申请、会议资料准备及递交等服务;
(3)负责对各学科资料(CMC、非临床和临床)的差距分析、风险评估和法规指导;
(4)负责按CTD各模块编写、翻译和制作英文NDA资料,并制作eCTD;
(5)提供ESG递交通道服务,负责将NDA递交至FDA;
(6)负责跟踪FDA审评进度,积极与FDA审评PM沟通联络;
(7)负责指导客户关闭FDA在审评过程中提出的各类缺陷(IRL、DRL、CRL等);
(8)提供NDA的日常维护服务,包括变更/增补、年报等;
(9)提供为生产厂址申请DUNS号、FEI号的服务;
(10)如有需要,可协助GMP部门为现场核查提供服务。
三、美国 NDA 简介
当申办者有足够数据(包括 CMC、非临床和临床数据)能证明药品的安全性和有效性满足了 FDA 对于上市的要求时, 申办者就可以向 FDA 递交新药申请(New Drug Application,NDA)。依据《食品、药品和化妆品法》(FD&C Act), 一般符合以下情况均可向 FDA 提出 NDA 申请:

依据处 方药申报者付费法案(Prescription Drug User Fee Act, PDUFA),NDA 是需要缴费的,其中 2021-2022 财年的 费用如下:
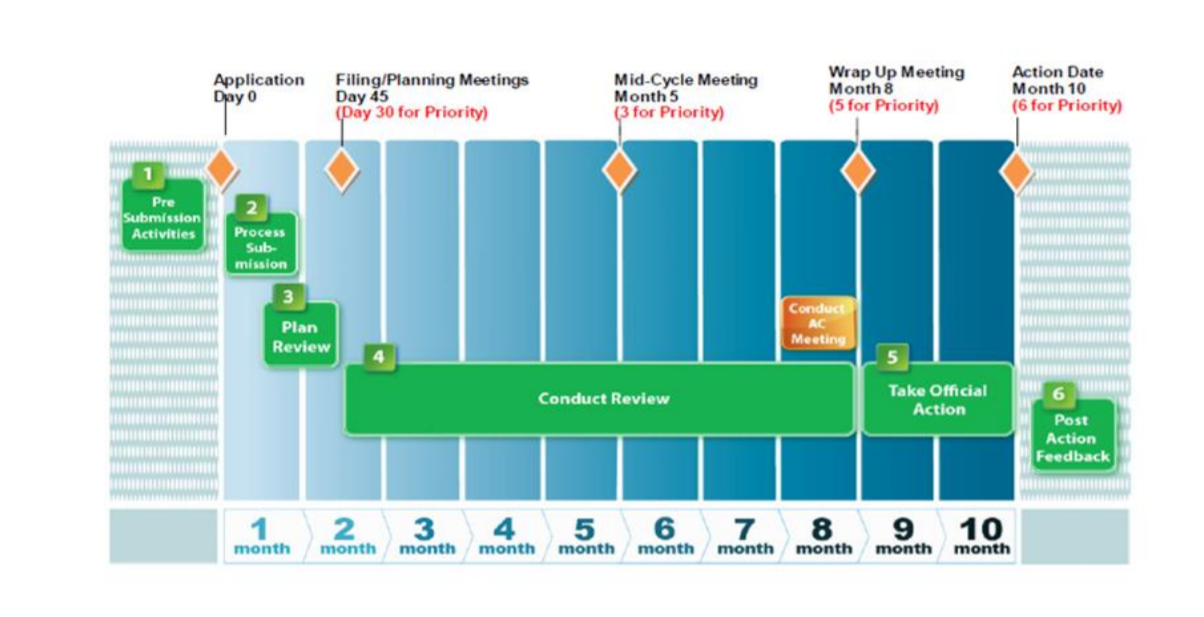
四、美国 NDA 注册流程