一、服务范围
为新的或现有的原料药(包含或未包含在 EP 药典或 EU 成员国药典中均可)提供在欧盟的 ASMF/EDMF 首次申报、缺 陷答复、变更递交等服务。
二、服务内容
(1)提供ASMF的基础培训,包括ASMF申请介绍、ASMF编写大纲培训等;
(2)提供中文ASMF的编写大纲,负责对中文ASMF的差距分析、风险评估和法规指导;
(3)负责编写英文ASMF,制作eCTD格式文件;
(4)提供建立CESP递交通道的服务;
(5)负责通过CESP通道递交至各国官方;
(6)负责与官方的技术联络,并帮助客户关闭ASMF缺陷直至完善;
(7)提供已完善的ASMF变更梳理、编写及递交;
(8)如有需要,可协助GMP部门为现场核查提供服务。
三、欧盟 ASMF/EDMF 简介
活性物质主文件(ASMF,Active Substance Master File),以前称为欧洲药物主文件(EDMF,European Drug Master File), 是由原料药生产商向 EMA 或欧盟各成员国药政递交的包含原料药保密信息的技术文件,用于支持制剂生产商的上市许 可申请。ASMF 的申请必须与使用该原料药的制剂的上市许可申请同时进行,其内容可分为公开部分和保密部分。
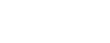
ASMF 的审评流程与索引该 ASMF 的制剂上市许可申报程序一致,具体分为以下几种:
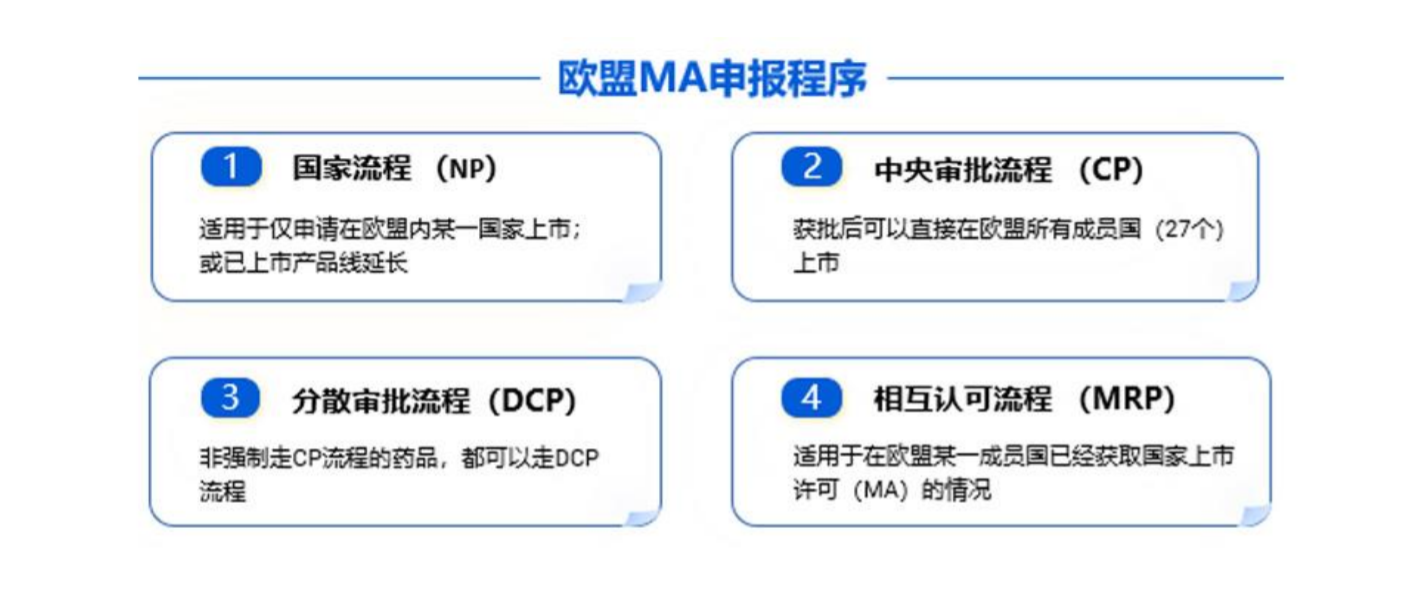
四、欧盟 ASMF 的注册流程
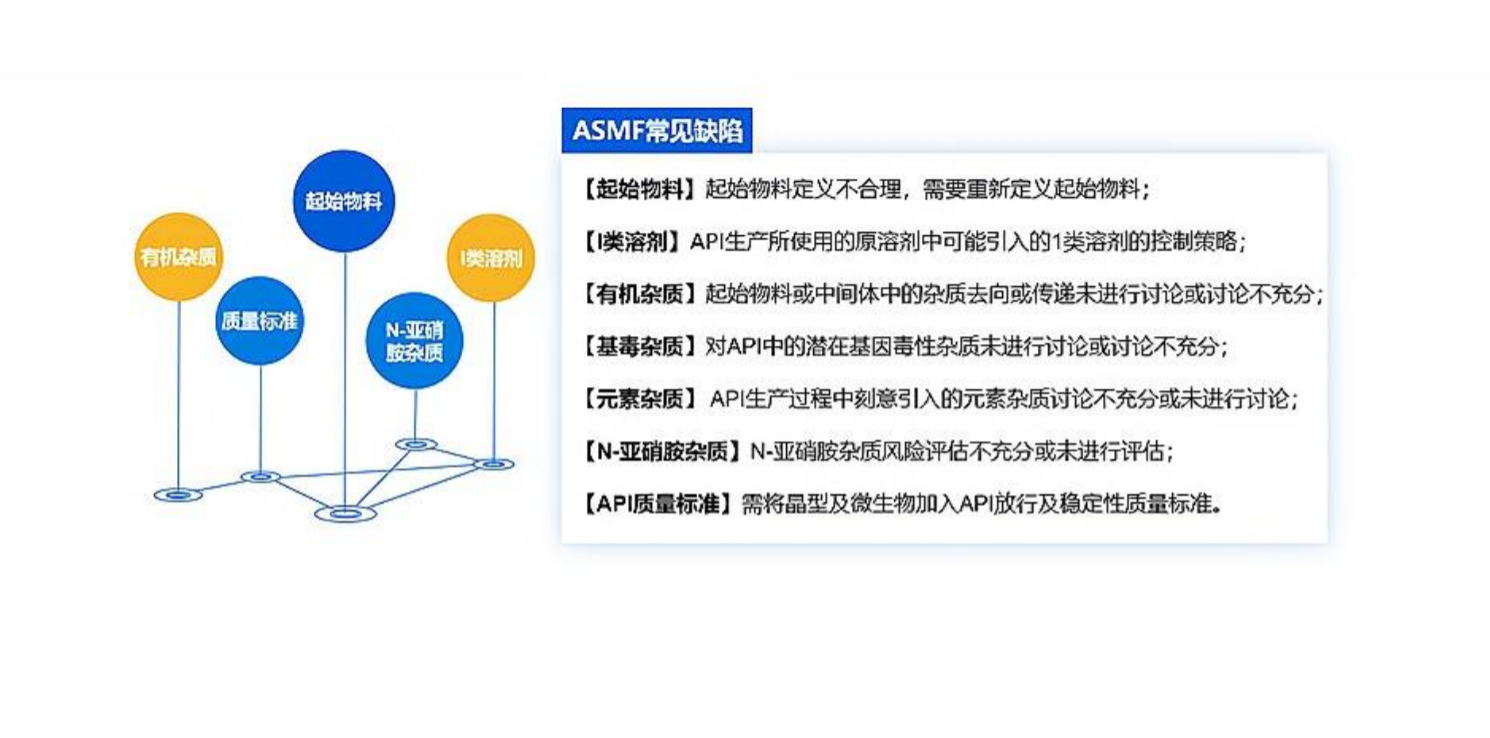
五、ASMF 的常见缺陷