一、服务范围
为符合欧洲药典各论或通则的原料药或辅料(通过合成、提取或发酵获得的有机或无机物)、具有 TSE 风险的产品、草 药及草药制剂提供在欧盟的 CEP/COS 首次申报、缺陷答复、变更递交、CEP 证书再注册等服务。
二、服务内容
CEP首次申报
(1)提供CEP的基础培训,包括CEP申请介绍、CEP编写大纲等;
(2)提供中文CEP的编写大纲,负责对中文CEP进行差距分析、风险评估和法规指导;
(3)负责编写英文CEP,制作eCTD格式文件;
(4)负责通过CESP通道递交CEP至EDQM;
(5)负责与EDQM的技术联络,并帮助客户关闭CEP缺陷以获得CEP证书;
(6)提供已获批的CEP申请姊妹CEP(CEP Sister File)服务;
(7)如有需要,可协助GMP部门为现场核查提供服务。
CEP日常维护
(1)提供已获批的CEP变更编写及递交、变更缺陷回复服务,直至变更获批;
(2)提供已获批的CEP证书再注册申请(Renewal)及递交服务。
三、欧盟 CEP/COS 简介
欧洲药典适用性证书(Certificate of Suitability to Monograph of European Pharmacopoeia),以前简称 COS,现在简 称 CEP。是由 EDQM 颁发的用以证明原料药的质量是按照欧洲药典各论描述的方法严格控制的,其产品质量符合欧洲 药典标准的一种证书。
经 EDQM 审批通过的原料药,将获得 CEP 证书。CEP 证书不仅得到所有欧盟成员国的认可,也得到了其他国家的承认, 例如加拿大、澳大利亚、新西兰、突尼斯和摩洛哥等。
CEP 证书可以分为以下几类:

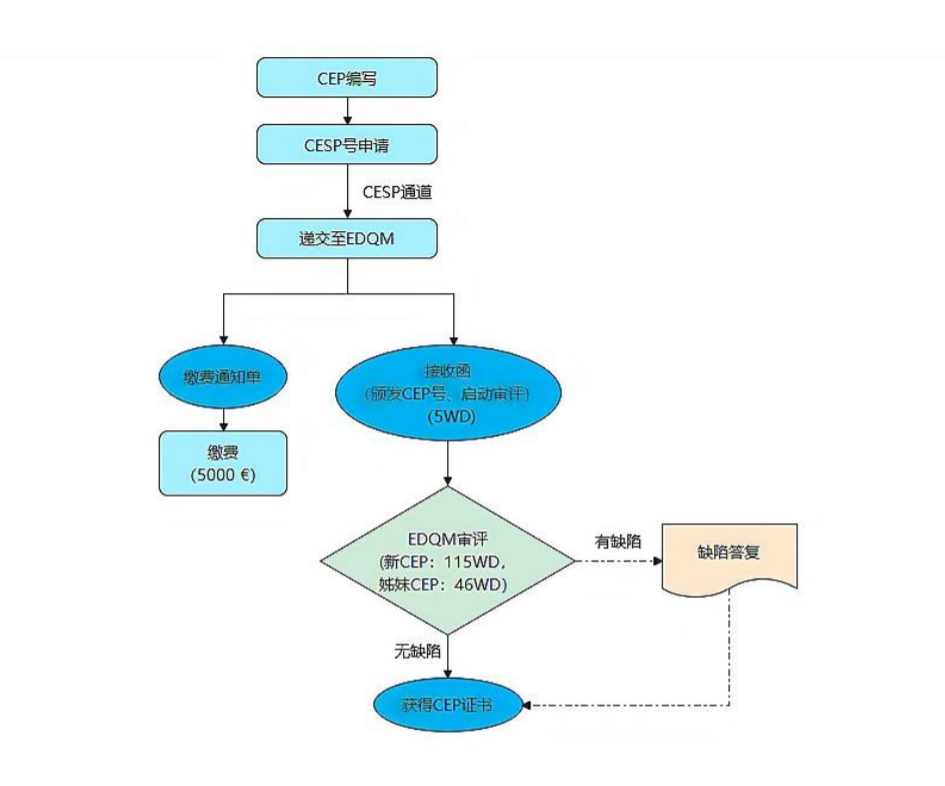
四、CEP 首次申报注册流程
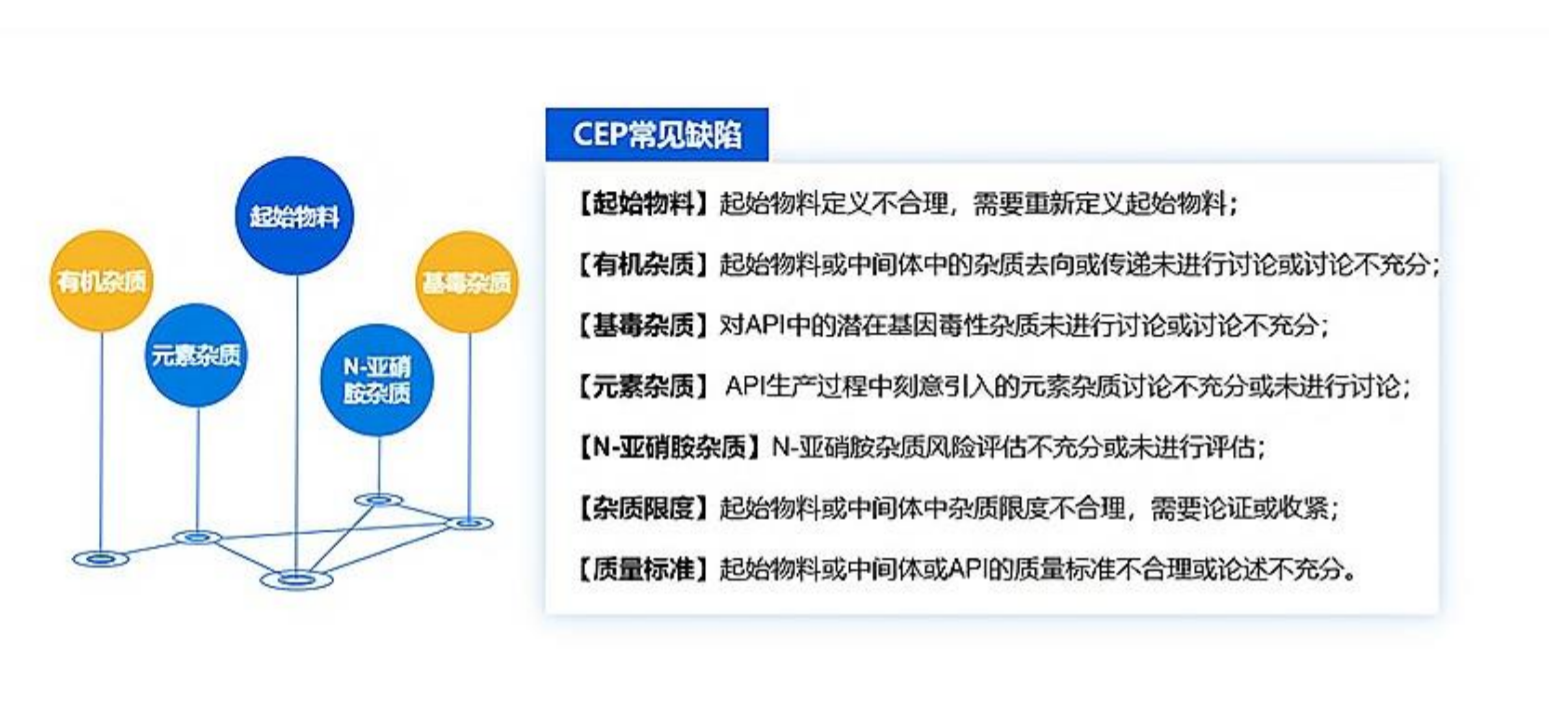
五、CEP 常见缺陷