一、 服务范围
为制剂药品欧洲注册申报及后续维护提供专业的、一站式、全生命周期的注册、GMP 咨询服务。
二、服务内容
申报前
(1)在项目立项过程中,调研、评估制剂药品欧洲注册的可行性
(2)在项目研发过程中,提供专业的技术和法规支持
(3)欧洲GMP符合检查与指导、协助客户完成整改
(4)申报资料的翻译和撰写,保证申报资料符合欧洲注册要求
(5)eCTD文件的制作
申报
(1)与欧洲审评机构沟通、协助开展会议申请、预约递交
(2)递交申报资料、跟踪审评进度、指导发补回复
(3)为欧洲GMP现场检查提供翻译以及技术支持
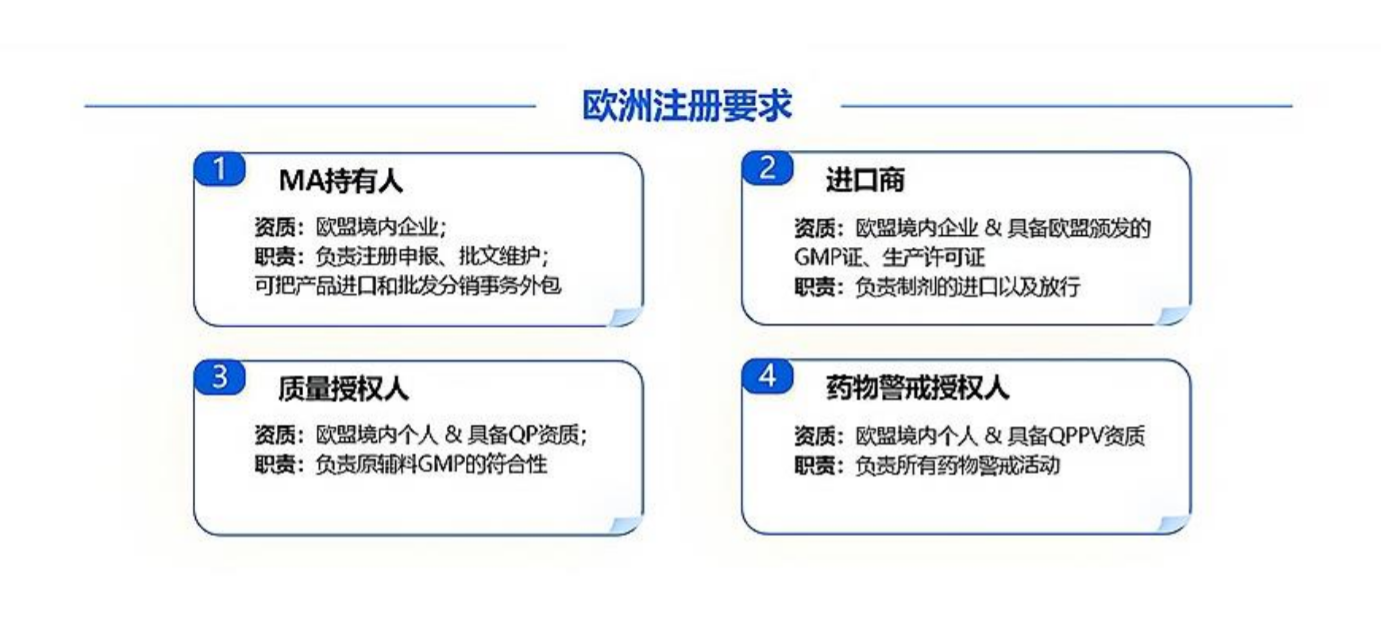
(4)如需要,可提供欧洲境内的上市许可持有人、进口商、QP、QPPV服务
申报后
(1)产品获批后的变更维护服务(Type IA、IB、II)
(2)产品获批后PV系统维护服务
(3)产品获批后的再注册服务
三、制剂申报途径

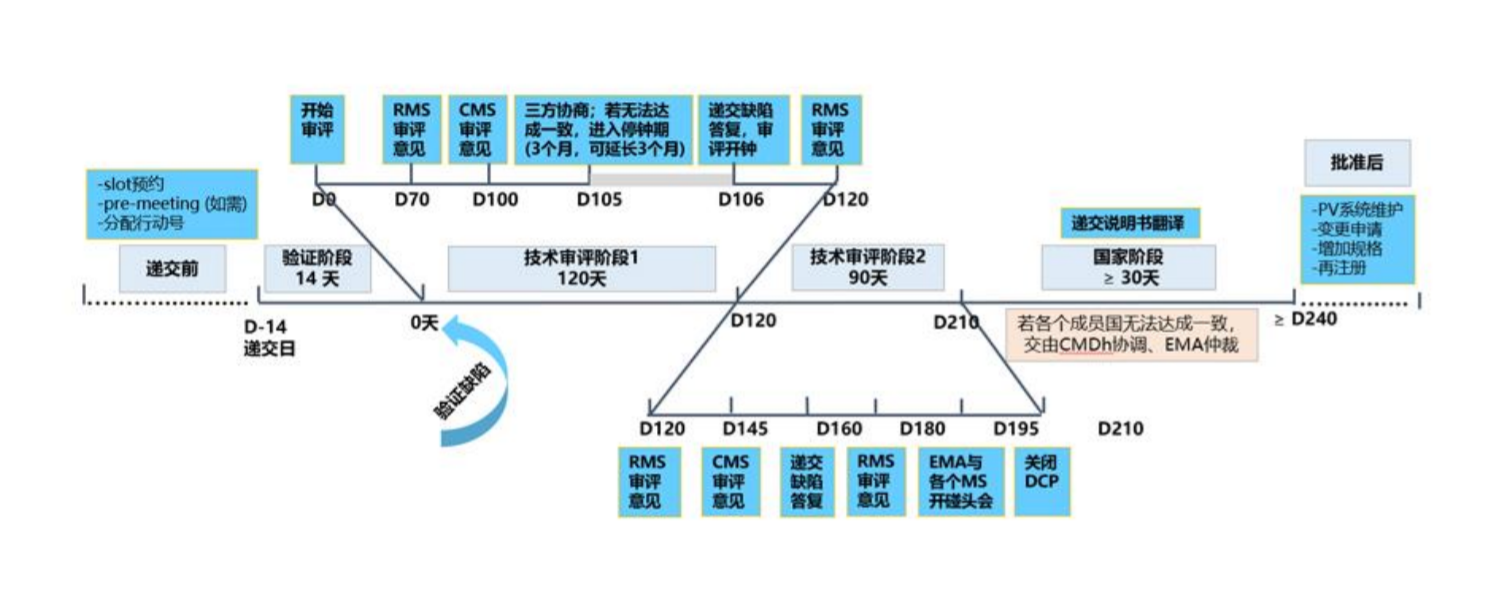
四、注册审评流程(以 DCP 为例)
五、欧洲注册特别要求